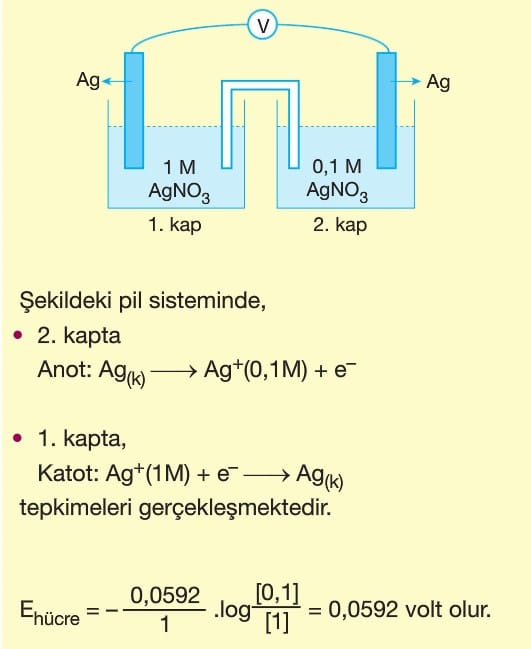
Elektrokimyasal Piller Kimya Ayt
Elektrokimyasal Piller:
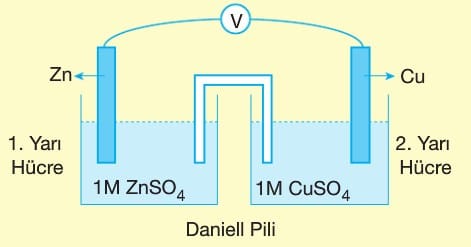
İstemli olarak gerçekleşen bir redoks tepkimesi ile kimyasal enerjiyi elektrik enerjisine dönüştüren düzeneklere Elektrokimyasal Pil, Galvanik hücre ya da Elektrokimyasal Hücre denir.
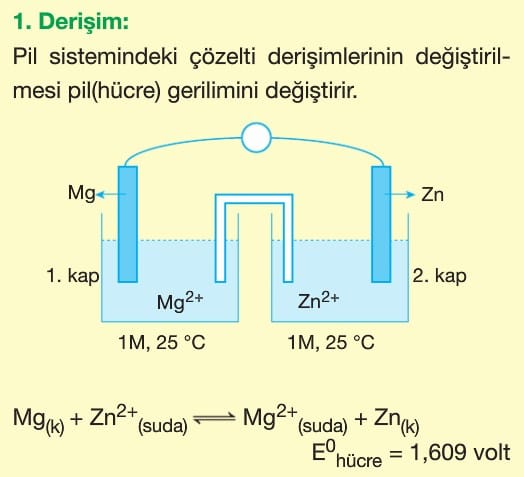
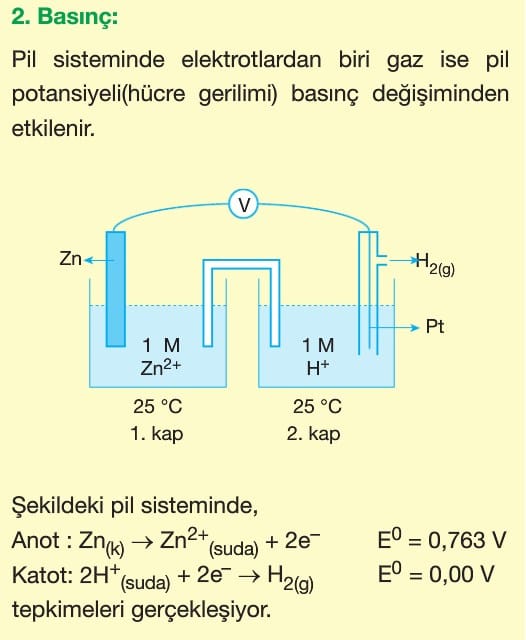
Pillerde redoks tepkimeleri kullanılan elementlerin elektron alma ve verme eğilimlerinin farklı olması ile gerçekleşir.
Elektrolit:
İçindeki anyon ve katyonlar ile elektriği ileten sıvılardır.
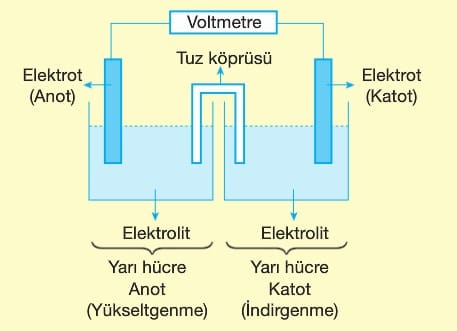
Tuz Köprüsü:
Yapısında suda çok çözünen (KCI, NaNO3 …) tuzların sulu çözeltilerini içeren U şeklindeki cam borulardır. Pillerde iki hücre arasında elektrik akımının geçmesini sağlar. Ayrıca hücrelerde yük dengesini korur.
Elektrot:
Elektrolit çözelti içine daldırılan, yükseltgenme ve indirgenme olaylarının gerçekleştiği iletken çubuklardır.
Yükseltgenmenin olduğu elektrota Anot, indirgenmenin olduğu elektrota Katot denir.
Anyon:
Negatif yüklü iyonlardır.
Katyon:
Pozitif yüklü iyonlardır.
Pil tepkimelerinde;
Aktifliği daha fazla olan elektrot yükseltgenir ve anot olur.
Anotun olduğu bölmede,
Yükseltgenme yarı tepkimesi gerçekleşir.
Elektrot çözeltiye iyonlarını verir ve aşınır.
Tuz köprüsünden anyonlar gelerek yük dengesini korumaya çalışır.
Yükseltgenme sonucu oluşan elektronlar dış devrede anottan katota doğru akar.
Redoks tepkimesi gerçekleştiği için alınan ve verilen elektron sayıları eşittir.
Yükseltgenme ve indirgenme yarı tepkimeleri toplanarak pil tepkimesi bulunur.
Kimyasal enerji elektrik enerjisine dönüşür.
Tepkimedeki ekzotermik dengelemeleridir.