Çözünürlük – Çözünürlüğe Etki Eden Faktörler Kimya Ayt
ÇÖZÜNÜRLÜK VE ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
Çözünme Olayı
Çözücüsü su olan homojen karışımlara sulu çözelti denir.
Bir karışım homojen (çözelti) olabilmesi için çözünen madde taneciklerinin çözücü molekülleri arasına girerek çözücünün her yerinde eşit oranda dağılması gerekir.
Bir maddenin bir sıvı içinde çözünmesinde etkili olan çekim kuvvetleri,
1. çözünen—çözünen etkileşimi
2. çözücü-çözücü etkileşimi
3. çözünen—çözücü etkileşimidir.
Çözünme olayının gerçekleşebilmesi için 1 ve 2 numaralı etkileşimler kırılmalı, 3 nolu etkileşim ise oluşmalıdır.
Yukarıdaki etkileşimlerin kuvvetlerine bağlı olarak üç farklı durum söz konusudur:
1. durum: Çözünen-çözücü etkileşiminin kuvveti diğer ikisinin toplamından daha büyük ise çözünme gerçekleşir ve ekzotermiktir.
2. durum: Çözünen-çözücü etkileşiminin kuvveti diğer ikisinin toplamından daha zayıf ise çözünme dışarıdan
ısı alarak gerçekleşir. Yani çözünme endotermiktir.
3. durum: Çözünen-çözücü etkileşiminin kuvveti çözünen-çözünen veya çözücü-çözücü etkileşimine göre çok zayıf ise çözünme gerçekleşmez ve heterojen karışım oluşur.
İyonik Katıların Çözünmesi
İyonik katılar H2O gibi polar çözücülerde iyi çözünürler. Çözünmede etkili olan çekim kuvveti iyondipol etkileşimidir.
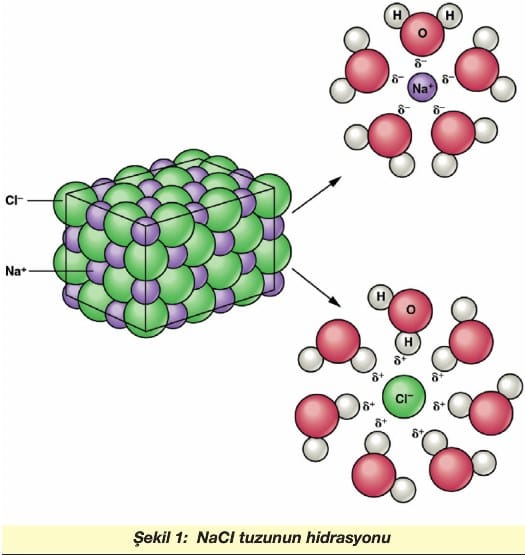
Örneğin; Yemek tuzunun suda çözünmesi; Na+ iyonları H2O molekülünün negatif yüklü (oksijen) uçlarıyla çevrelenirken, CI– iyonları pozitif yüklü (hidrojen) uçlarıyla sarılır. Bu olaya hidrasyon denir. (Şekil 1)
Kovalent Moleküllerin Çözünmesi
Apolar kovalent moleküller apolar çözücülerle homojen karışım oluştururlar. Çözünmede indüklenmiş dipol- indüklenmiş dipol çekim kuvveti etkindir.
Apolar hekzan (C6H14) molekülleri ile apolar oktan (C8H18) molekülleri homojen karışım oluşturur.
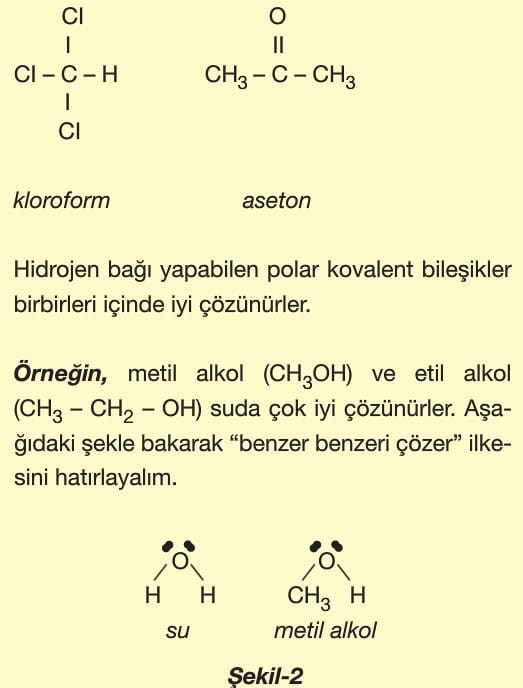
Polar kovalent moleküller birbirleri içerisinde dipol-dipol etkileşimiyle iyi çözünürler. Kloroform ve aseton her ikisi de polar olduklarından çözelti oluştururlar.
Çözeltilerin Sınıflandırılması ve Çözünürlük Kavramı
1. Derişik-Seyreltik
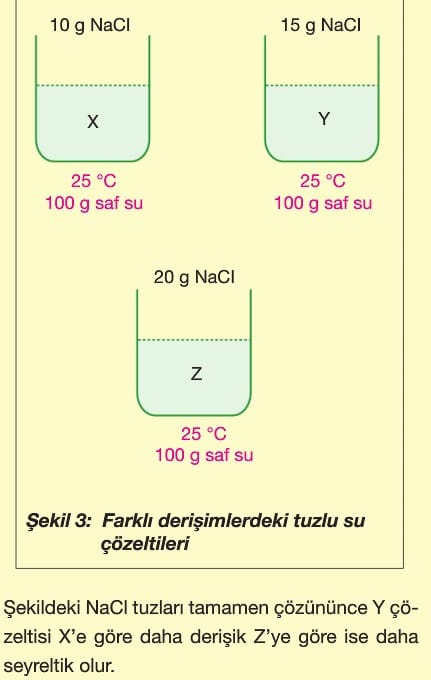
Derişik ve seyreltik kavramları, aynı cins çözeltileri çözünen madde oranına göre birbirleriyle kıyaslamak için kullanılır. Farklı derişimdeki çözeltiler birbirine göre derişik veya seyreltiktir. Şekil 3’ü inceleyiniz.
2. Doygun-Doymamış-Aşırı doygun
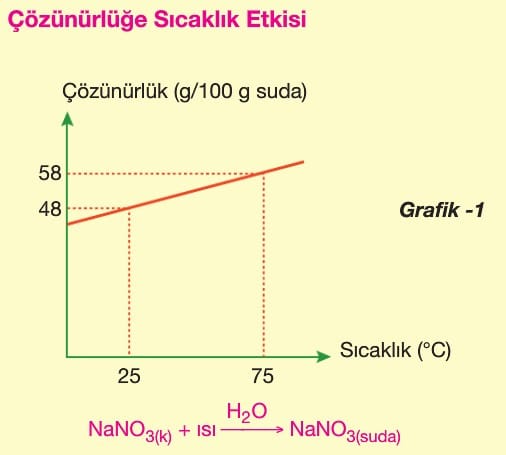
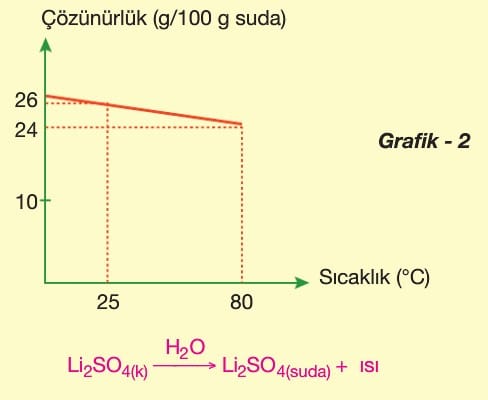
Bir maddenin belirli bir sıcaklıkta ve belirli bir miktardaki çözücüde çözünebilen maksimum madde miktarına çözünürlük denir. Genellikle çözücü olarak su kullanıldığından, çözünürlük belirli bir sıcaklıkta bir maddenin 100 g suda çözünebilen maksimum madde miktarı olarak ifade edilir.
Çözünürlüğe Etki Eden Faktörler
Çözünürlüğe;
1. Çözünen veya çözücü maddenin cinsi
2. Sıcaklık
3. Basınç
etki eder.
Çözünürlüğe Basınç Etkisi
Katı ve sıvıların çözünürlüğüne basınç etki etmez. Gazların çözünürlüğü basınç arttıkça artar. Gazlı içeceklerin şişe kapakları basınçla kapatılır. İçmek için kapağını açtığımızda kaptaki basınçtan dolayı çözünürlük azalır ve gaz çıkışı olur. Gazların sıvılardaki çözünürlüğü