Çözünme – Çökelme Tepkimeleri 11. sınıf kimya
- Sabit bir sıcaklıkta 100 g çözücüde çözünebilen maksimum madde miktarına çözünürlük denir.
- Sabit bir sıcaklıkta 1 L doygun çözeltide çözünmüş olarak bulunan madde miktarına molar çözünürlük denir.
- 1 L doygun çözeltide 0,1 mol’den daha az madde çözünürse bu maddeler az çözünür denir.
- Çözünme olayı kimyasal ya da fiziksel olabilir.
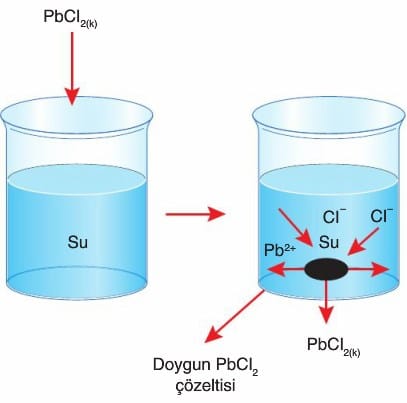
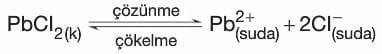
- Yukarıdaki şekilde saf su bulunan kaba sabit sıcaklıkta, sudaki çözünürlüğü endotermik olan PbCl2 katısı atılınca zamanla çözünme gerçekleşir ve çözelti doyar.
- Kapta, başlangıçta düzensizlik eğilimi çözünmeyi desteklerken minimum enerjiye eğilim çökmeyi destekler.
- Çözünen katının iyonları birbirleri ile çarpıştıkları gibi katının yüzeyine de çarparlar. Katı yüzeyine çarpan taneciklerden yavaş ve kinetik enerjisi düşük olanlar katı yüzeyinin çekim kuvvetinden kurtulamazlar ve katıya yapışırlar.
- Bir süre sonra çözünme ve çökelme hızları birbirlerine eşit olur ve dengeye ulaşılır. Bu durumda doygun çözelti oluşmuştur.
- Doygun çözeltide, çözeltiye geçen ve çöken iyonlar arasında kurulan dengeye çözünürlük (çözünme-çökelme) dengesi denir.
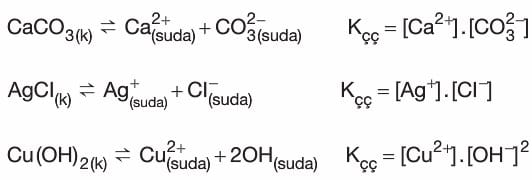
- Bu dengeye ait Kc denge bağıntısı yazılırsa:
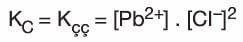
bağıntısı elde edilir. - Doygun çözeltideki iyonların derişimleri çarpımına çözünürlük çarpımı denir ve Kçç ile gösterilir.
- Kçç bağıntılarındaki derişimler, çözünen katının molar çözünürlüğünden bulunur.
- Tepkimelerdeki iyonların denklem katsayıları Kçç bağıntılarında derişimlerin üzerine üst olarak yazılır.
- Aşağıda bazı katıların sudaki çözünme denklemleri ve Kçç bağıntıları verilmiştir.
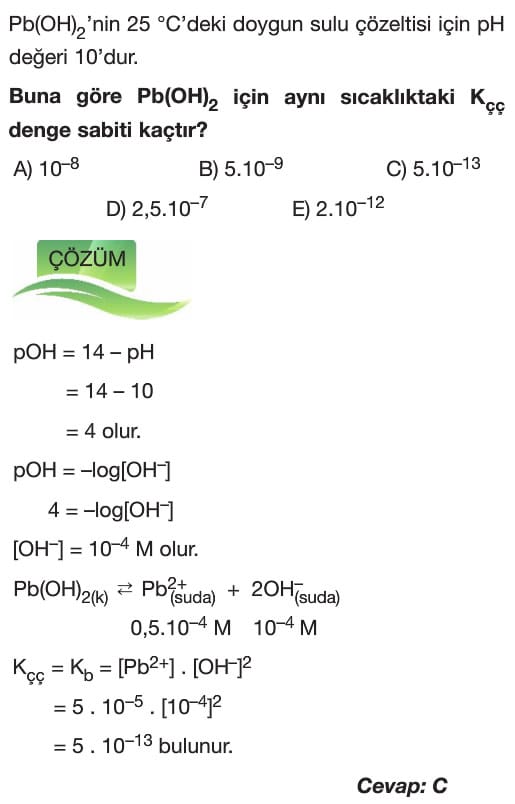
Çözümlü Sorular
Çözünürlük Dengesine Etki Eden Faktörler
1 . Sıcaklık Etkisi
- Suda çözünmesi endotermik olan maddelerin çözünürlüğü sıcaklık arttıkça artar. Sıcaklık ile denge ürünlere doğru kayacağından çözünürlük çarpımı (Kçç) artar.
- Suda çözünmesi ekzotermik olan maddelerin çözünürlüğü sıcaklık arttıkça azalır. Sıcaklık ile denge girenlere doğru kayacağından çözünürlük çarpımı (Kçç) de azalır.
- (Kçç) bir denge sabiti olduğundan yalnız sıcaklık ile değişir.
Dikkat: Kimyasal denge konusunda gördüğümüz “dengeye etki eden faktörleri” çözünürlük dengesi kısmında da kullanacağız.
2. Ortak İyon Etkisi
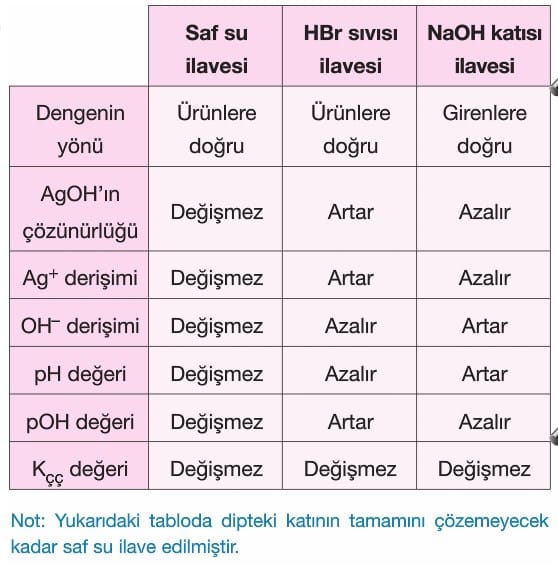
- Doygun bir çözeltiye, çözeltideki iyonlardan birisini içeren başka bir katı sabit sıcaklıkta eklendiğinde ortak iyon etkisi oluşur, denge girenlere doğru kayar ve çözünürlük azalır.
- Ortak iyon etkisi ile çözünürlük çarpımı (Kçç) değişmez.
- Doygun AgCl çözeltisine NaCl katısı eklenirse:
→ Çözünme denklemleri,
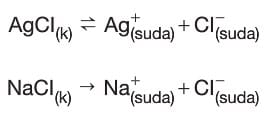
şeklinde olur.
→ AgCl az çözünen tuz olduğundan çözünme denklemi denge halinde gösterilir. NaCl çok çözünen tuz olduğundan çözünme denklemi tek yönlü ok ile gösterilir.
→ Cl– iyonu ortak olduğundan denge girenler tarafına doğru kayar ve bir miktar AgCl katısı çöker.
→ AgCl’nin çözünürlüğü azalmıştır.
→ Ag+ iyonlarının molar derişimi azalmıştır.
→ Sıcaklık sabit kaldığı için Kçç sabiti değişmez.
→ Sorular Kçç bağıntısından çözülür.
→ Çözünürlükten gelen derişim çok küçük olduğu için toplama ve çıkarma işlemlerinde genellikle ihmal edilir.
→ Suda az çözünen bir katının saf sudaki çözünürlüğü, aynı sıcaklıkta ortak iyon içeren bir çözeltideki çözünürlüğünden daima daha büyüktür.
3. pH Etkisi
- Denge, suda az çözünen asit ya da baza ait ise sabit sıcaklıkta yapılan bir işlem ile çözeltideki H+ ve OH– iyonları derişimleri değişebilir. Bu durumda pH ve pOH değerleri de değişir.
- Sıcaklık sabit ise Kçç yani Ka ya da Kb denge sabitleri değerleri değişmez.
- Sabit sıcaklıkta,
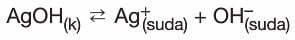
dengesi kurulu, katısı ile dengede olan çözelti için aşağıdaki tabloyu inceleyiniz:
Bilgi: Çözücü ve çözünenin miktarının değiştirilmesi ile çözünürlük değişmez. çözeltinin karıştırılması ile de çözünürlük değiştirmez. Yalnız çözünmenin hızı artar.
Çözümlü Sorular
Çözünme-Çökelme Tepkimeleri video 11. sınıf Hocalara Geldik
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 0 YORUM