Çözücü – Çözünen Etkileşimleri 11. sınıf kimya
Özellikle sıvı çözeltilerde çözünme süreci çözücü ve çözünen etkileşimleri ile işlenecektir.
Homojen Karışım (Çözelti): Özelliği her yerinde aynı olan, tek görünümlü karışımlardır. Temiz hava, doğalgaz, tuzlu su, gazoz, sirke gibi maddeler homojen karışıma örnektir.
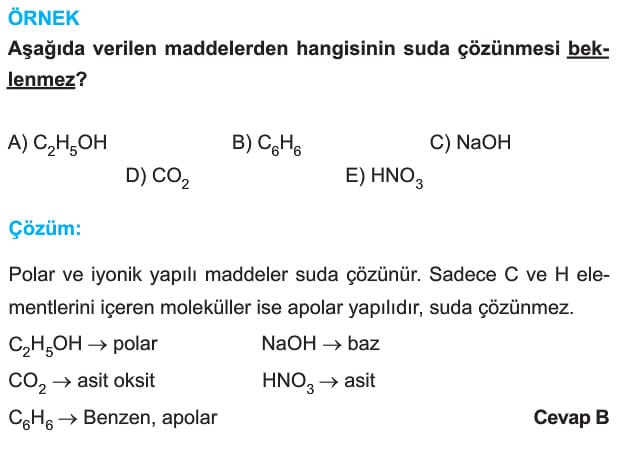
Çözünme: Birbirine benzer bileşenlerin moleküler ya da iyonal düzeyde, fiziksel ya da kimyasal bir olay şeklinde bir araya gelmesiyle gerçekleşir. Moleküler yapıları benzer bileşenler birbiri içinde çözünerek homojen karışım oluştururlar. Polar moleküller polar çözücülerde apolar moleküller ise apolar çözücülerde daha iyi çözünür.
Çözücü: Çözünen maddenin homojen şekilde dağılmasını sağlayan ortamdır. Genelde miktarca daha fazla olandır. çözeltinin fiziksel halini belirler. Çözüneni katı olması durumunda hacmi de belirler.
Çözünen: Çözücü ortamında homojen olarak dağılan maddedir. Bir çözeltide çözünen ve çözücü kütleleri toplamı çözeltinin kütlesini verir.
mçözücü + mçözünen = mçözelti
Bilgi: Çözücü ve çözünen arasındaki etkileşim türleri çözünme miktarını belirler.
Çözünme Isısı
Çözünme olayı üç basamakta incelenir ve her basamağa bir enerji eşlik eder.
Basamak 1: Çözücü moleküllerinin birbirinden ayrılması (Q1)
Basamak 2: Çözünen moleküllerinin birbirinden ayrılması (Q2)
Basamak 3: Çözünen moleküllerinin çözücü molekülleri tarafından sarılması (Q3)
Çözünme olayındaki enerji değişimi çözünme ısısı (Qçözünme) ile belirtilir.
Qçözünme = Q1 + Q2 + Q3
Qçözünme > 0 ise çözünme endotermik
Qçözünme < 0 ise çözünme ekzotermiktir.
Bilgi: Çözünen taneciklerin su molekülleri ile sarılması olayına hidratasyon, farklı bir çözücü molekülleri ile sarılmasına ise solvatasyon denir.
- Çözünme olayında çözünen tanecikleri su molekülleri tarafından sarılır. Bu olaya hidratasyon ve enerji değişimine ise hidratasyon enerjisi denir. Çözücünün su dışında bir başka sıvı olması durumunda bu sıvının molekülleri çözünen moleküllerini sarar. Bu olaya da solvatasyon denir. Hidratasyon çözünme olayında 1. ve 3. basamakları kapsar.
Yukarıda NaCl (yemek tuzunun) sulu ortamda çözünme olayı gösterilmiştir. Na+ iyonları su molekülünün kısmi negatif olduğu oksijen atomları ile sarılırken Cl– iyonları ise su molekülünün kısmi pozitif olduğu hidrojen atomları ile sarılmaktadır. NaCl kristalinden gelen iyonlar su molekülleri ile hidratasyona uğrar. Bu sırada iyon dipol etkileşimleri oluşur.
Bilgi: İyonik bir kristalde katının gaz haldeki iyonlarına dönüşmesi için gereken enerjiye kristallenme enerjisi denir. Kristallenme ve hidratasyon enerjisinden faydalanarak çözünme ısısı belirlenebilir.
(Qçözünme = -Qkristallenme + Qhidratlaşma)
Çözücü ve Çözünen Etkileşimleri Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Çözücü – Çözünen Etkileşimleri
Çözeltiler, bir çözücünün ve bir çözünen maddenin homojen bir karışımıdır. Çözücü ve çözünen maddeler arasındaki etkileşimler, çözünme sürecini etkileyen temel faktörlerdir. Bu etkileşimler, çözünme hızı ve çözeltilerin özellikleri üzerinde belirleyici rol oynar.
1. Polar bir çözücü içinde iyonik bir katının çözünme süreciyle ilgili aşağıdaki ifadelerden hangisi doğrudur?
A) İyonlar çözücü molekülleriyle kuvvetli etkileşimler kurarak çözünür.
B) Çözünme sürecinde sadece moleküler kuvvetler etkilidir.
C) İyonlar çözücü moleküllerinden uzaklaştırılır.
D) Çözünme sadece çözünenin yüzeyindeki moleküllerle gerçekleşir.
Çözüm: Polar çözücüler, iyonik katıları çözerek iyonları çözücü molekülleri ile çevreler. Bu etkileşim sonucu iyonlar çözünür. Cevap A.
2. Sıcak su ile oda sıcaklığındaki su arasında bir tuzun çözünme hızı açısından ne fark gözlenir ve bu durum hangi etkiye bağlıdır?
A) Sıcak suda çözünme hızı daha yüksektir, çünkü taneciklerin kinetik enerjisi artar.
B) Sıcak suda çözünme hızı daha yavaştır, çünkü çözünme endotermik bir süreçtir.
C) Sıcak suda çözünme hızı aynıdır, çünkü çözünme sadece çözücünün türüne bağlıdır.
D) Oda sıcaklığındaki su daha yüksek çözünme hızına sahiptir, çünkü çözücü daha kararlıdır.
Çözüm: Sıcaklık arttıkça, çözücü moleküllerinin kinetik enerjisi artar ve bu da çözünme hızını artırır. Bu nedenle sıcak su, oda sıcaklığındaki suya göre daha hızlı çözündürme sağlar. Cevap A.
3. Bir çözücü, bir çözünen maddeyi çözüyorsa bu süreçteki etkileşimler hakkında aşağıdakilerden hangisi yanlıştır?
A) Çözücü molekülleri ile çözünen moleküller arasında çekim kuvvetleri oluşur.
B) Çözücü, çözünenin katı formunu parçalayarak çözünmeyi başlatır.
C) Çözünme sürecinde çözücü ve çözünen arasında zayıf etkileşimler oluşur.
D) Çözünme sadece çözünen madde yeterince küçükse gerçekleşir.
Çözüm: Çözücü ve çözünen arasında güçlü etkileşimler çözünme sürecinde önemli bir rol oynar. Zayıf etkileşimler çözünmeyi zorlaştırır. Cevap C.
4. Polar bir çözücüde çözünmeyen bir çözünen maddeye örnek olarak ne verilebilir ve bu durumun sebebi nedir?
A) Sodyum klorür, çünkü iyonik yapıya sahiptir.
B) İyot, çünkü apolar bir moleküldür.
C) Şeker, çünkü polar yapıdadır.
D) Alkol, çünkü polar çözücülerle karışır.
Çözüm: İyot (I₂) apolar bir molekül olduğu için polar bir çözücüde çözünmez. Polar çözücüler, polar maddelerle iyi etkileşir. Cevap B.
5. Bir çözelti oluşurken çözünme sürecinde çözücü ve çözünen moleküllerinin etkileşimleri için aşağıdaki ifadelerden hangisi doğrudur?
A) Sadece fiziksel kuvvetler etkilidir.
B) Kimyasal bağlar oluşur.
C) İyon-dipol etkileşimleri önemli rol oynar.
D) Çözünenin moleküler yapısı önemsizdir.
Çözüm: Özellikle iyonik çözeltilerde, iyon-dipol etkileşimleri çözünme sürecinde belirleyici rol oynar. Cevap C.
6. “Benzer benzeri çözer” prensibine göre polar bir çözücünün çözeceği maddeler hangi özelliklere sahip olmalıdır?
A) Apolar moleküllerden oluşmalıdır.
B) Polar yapıda olmalıdır.
C) Katı formda olmalıdır.
D) Moleküler yapısı önemsizdir.
Çözüm: Polar çözücüler, polar maddelerle daha iyi etkileşim kurar. Bu nedenle “benzer benzeri çözer” prensibine göre polar çözücüler polar çözünenleri çözebilir. Cevap B.