Çözeltilerin Günlük Hayattaki Yeri Kimya Tyt
ÇÖZELTİLERİN GÜNLÜK HAYATTAKİ YERİ
Derişim
Belirli bir miktar çözücü ya da çözeltide çözünmüş madde miktarına derişim denir.
Bazı Derişim Çeşitleri
- Kütlece Yüzde Derişim
- Hacimce Yüzde Derişim
- ppm
Kütlece Yüzde Derişim
100 gram çözeltide çözünmüş madde miktarına kütlece yüzde derişim denir.
Doymamış bir çözeltiye çözücü eklenirse çözeltinin kütlece yüzde derişimi azalır.
Bir çözeltiye çözünen eklenirse (çökme olmamak şartıyla) çözeltinin kütlece yüzde derişimi azalır.
Bir çözeltiden çözücü buharlaştırılırsa (çökme olmamak şartıyla) çözeltinin kütlece yüzde derişimi artar.
Koligatif Özellikler
Çözünenin türüne bağlı olmayan ve taneciklerinin derişimine bağlı olarak değişebilen özelliklere korigatif özellikler denir.
Bazı Koligatif Özellikleri
- Kaynama noktası yükselmesi
- Donma noktası alçalması
- Ozmotik basınç
Saf suda uçucu olmayan bir katı çözündüğünde kaynama ve donma noktalarında değişim gerçekleşirken ortaya ozmotik basınç özelliği çıkmaktadır.
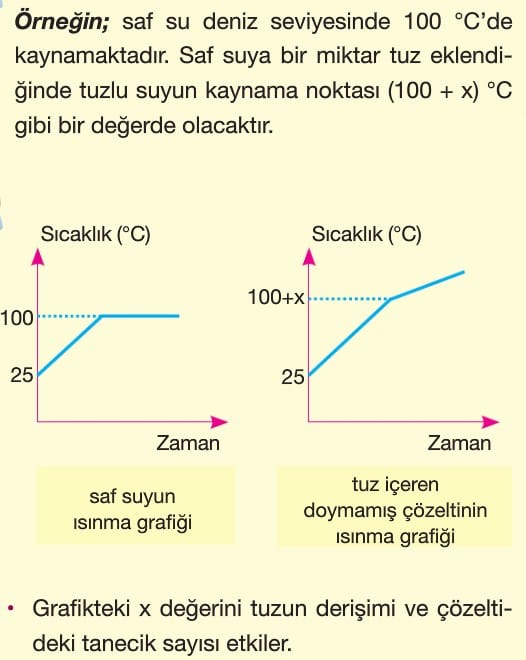
Kaynama Noktası Yükselmesi
Uçucu olmayan bir katı, saf bir sıvıda çözündüğünde buhar basıncında düşme kaynama noktasında ise bir artış gerçekleşir.
Kaynama noktasındaki bu artışa kaynama noktası yükselmesi (ebülyoskopi) denir.
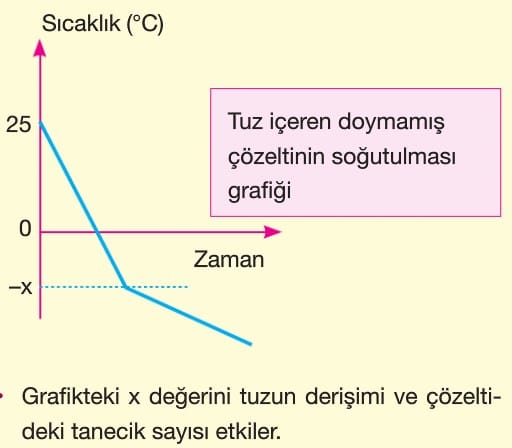
Donma Noktası Alçalması
Uçucu olmayan bir katının bir çözücüde çözünmesi sonucunda çözeltinin donmaya başlama sıcaklığı düşer. Donma noktasındaki düşme değerine donma noktası alçalması (kriyoskopi) denir.
Örneğin; Saf su deniz seviyesinde 0 oC’de donmaya başlar. Saf suda bir miktar tuz çözünürse tuzun suya verdiği iyonlar ile su molekülleri arasında oluşan iyon-dipol zayıf etkileşimi su moleküllerinin düzensizliğini artırır. Dolayısıyla donma noktası —x oC gibi düşük sıcaklıklarda gerçekleşir.
– Uçucu olmayan katıların çözünme sırasında ortama verdiği tanecik derişimi ile donma noktasındaki düşüş doğru orantılıdır.
– Alkol ve şeker gibi suda çözünen maddeler de çözeltinin donma noktasını düşürür.
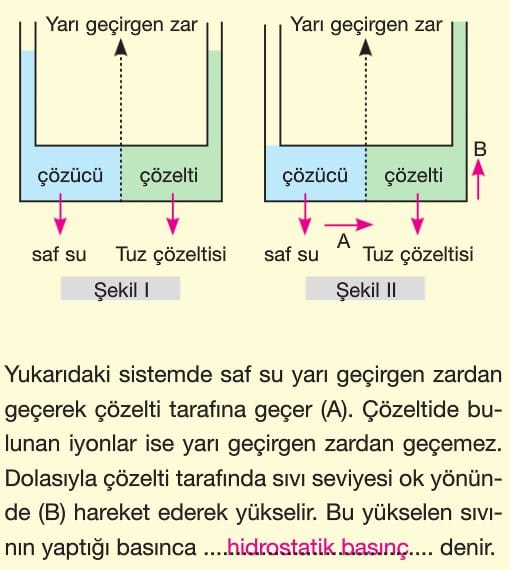
Ozmotik Basınç
Saf su ya da derişimi düşük olan bir sulu çözelti ile derişimi yüksek olan bir sulu çözelti arasına yarı geçirgen bir zar konulursa derişimi yüksek olan çözeltiye su geçişi gerçekleşir bu olaya ozmos denir.