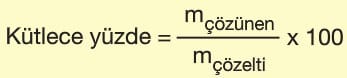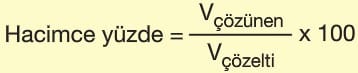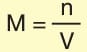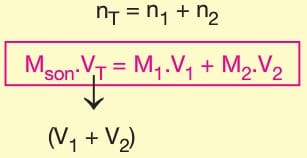Çözeltilerde Derişim Hesaplama Formülleri Kimya Ayt
DERİŞİM HESAPLAMA
Kütlece Yüzde Derişim
100 gram çözeltide çözünen maddenin kütlesidir.
Hacimce Yüzde Derişim
100 hacim çözeltide çözünen maddenin hacmidir. Sıvı-sıvı ve gaz-gaz karışımlarında yaygın olarak kullanılır.
ppm (Milyonda Bir Kısmı)
ppm = parts per million
Kütlece veya hacimce milyonda derişim şeklinde ifade edebiliriz. Çözünenin kütlece veya hacimce yüzdesi çok küçük olduğu durumlarda kullanılır.
Yukarıdaki derişim birimlerinin hepsinde paydada Çözücü değil çözelti miktarı olduğuna dikkat edelim. Yukarıdaki tüm formüllerde pay ve paydadaki birimler aynı olmalıdır.
Mol kesri
Karışımdaki bir maddenin mol sayısının, karışımdaki tüm maddelerin mol sayılarının toplamına oranına denir.
Molarite (Molar Derişim)
Kimyada en yaygın kullanılan derişim birimidir. Molarite, 1 L çözeltide çözünen maddenin mol sayısıdır.
Çözeltilerin Deriştirilmesi ve Seyreltilmesi
Deriştirme;
1. Çözünen ekleme
2. Çözücü buharlaştırma
Seyreltme;
1. Çözünen çöktürme
2. Çözücü ekleme
ile yapılabilir.
Çözünen ekleme veya çöktürme hesaplamalarında değişen mol sayısına göre molarite formülünü kullanmak daha pratiktir.
Çözücü ekleme veya buharlaştırma hesaplamalarında çözünenin mol sayısı değişmiyor ise,
Çözeltilerin Karıştırılması
Aynı çözüneni içeren farklı derişimli çözeltiler karıştırıldığında mol sayılarının toplamından türetilen aşağıdaki formülle son derişim bulunur.
Molalite (Molal Derişim)
Molalite, 1 kg çözücüde çözünen maddenin mol sayısıdır.
Molal derişim olarak da ifade edilir. Bir sonraki bölümde öğreneceğimiz çözeltilerin koligatif özellikleri ile ilgili hesaplamalarda yaygın olarak kullanılır.
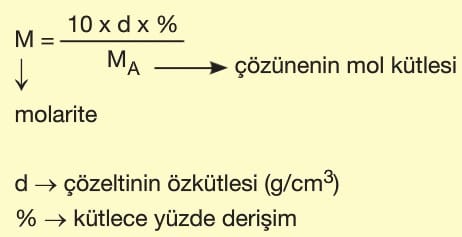
Kütlece Derişimin Molar Derişime Çevrilmesi
Genellikle laboratuvarda çözelti halinde bulunan kimyasalların şişeleri üzerinde kütlece yüzde derişim ve özkütle değerleri yazılıdır. Bu iki veri aşağıdaki formülde yerine yazılarak molar derişim bulunabilir.
Çözümlü Örnek Test Soruları
Soru 1:
Bir çözeltinin molaritesi (M) nasıl hesaplanır?
A) Çözeltinin kütlesi / çözeltinin hacmi
B) Çözücünün mol sayısı / çözeltinin hacmi
C) Çözücünün hacmi / çözücünün mol sayısı
D) Çözünenin mol sayısı / çözeltinin hacmi
Çözüm: Molarite, çözünen maddenin mol sayısının çözeltinin hacmine bölünmesiyle hesaplanır.
Cevap: D
Soru 2:
200 mL 0.5 M NaCl çözeltisinde kaç mol NaCl vardır?
A) 0.1 mol
B) 0.2 mol
C) 0.3 mol
D) 0.4 mol
Çözüm: Molarite (M) = mol / litre olduğundan, mol sayısı = 0.5 M x 0.2 L = 0.1 mol NaCl bulunur.
Cevap: A
Soru 3:
Bir çözeltinin yüzde kütle derişimi nasıl hesaplanır?
A) Çözeltinin kütlesi / çözünenin kütlesi
B) Çözücünün kütlesi / çözeltinin kütlesi
C) Çözünenin kütlesi / çözeltinin kütlesi x 100
D) Çözeltinin hacmi / çözünenin kütlesi x 100
Çözüm: Yüzde kütle derişimi, çözünenin kütlesinin çözeltinin kütlesine oranının 100 ile çarpılmasıyla bulunur.
Cevap: C
Soru 4:
3 mol KNO₃ çözerek hazırlanan 1.5 L çözeltinin molaritesi nedir?
A) 1 M
B) 2 M
C) 3 M
D) 4 M
Çözüm: Molarite (M) = mol / litre; dolayısıyla M = 3 mol / 1.5 L = 2 M olur.
Cevap: B
Soru 5:
Bir çözeltinin yüzde hacim derişimi nasıl hesaplanır?
A) Çözeltinin hacmi / çözücünün hacmi
B) Çözünenin hacmi / çözeltinin hacmi x 100
C) Çözeltinin hacmi / çözünenin hacmi
D) Çözünenin hacmi / çözücünün hacmi x 100
Çözüm: Yüzde hacim derişimi, çözünenin hacminin çözeltinin hacmine oranının 100 ile çarpılmasıyla hesaplanır.
Cevap: B
Soru 6:
Bir çözeltinin molalitesi (m) aşağıdaki formüllerden hangisi ile hesaplanır?
A) Çözünen mol sayısı / çözeltinin hacmi
B) Çözünen mol sayısı / çözücünün kg cinsinden kütlesi
C) Çözücünün mol sayısı / çözeltinin hacmi
D) Çözünen mol sayısı / çözeltinin hacmi x 1000
Çözüm: Molalite, çözünenin mol sayısının çözücünün kilogram cinsinden kütlesine bölünmesiyle bulunur.
Cevap: B
Soru 7:
1.5 mol NaOH kullanılarak hazırlanan 500 mL çözeltinin molaritesi kaçtır?
A) 2 M
B) 3 M
C) 4 M
D) 5 M
Çözüm: Molarite (M) = mol / litre; dolayısıyla M = 1.5 mol / 0.5 L = 3 M olur.
Cevap: B
Soru 8:
Yüzde kütle / hacim (% m/v) derişimi nasıl hesaplanır?
A) Çözünenin kütlesi / çözeltinin hacmi x 100
B) Çözeltinin hacmi / çözünenin hacmi x 100
C) Çözünenin hacmi / çözeltinin hacmi x 100
D) Çözeltinin kütlesi / çözücünün kütlesi x 100
Çözüm: Yüzde kütle / hacim derişimi, çözünenin kütlesinin çözeltinin hacmine oranının 100 ile çarpılmasıyla hesaplanır.
Cevap: A