Çözeltilerde Çözünme ve Çökelme Olayları Kimya Ayt
ÇÖZELTİLERDE ÇÖZÜNME VE ÇÖKELME OLAYLARI
ÇÖZÜNÜRLÜK VE Kçç BAĞINTILARININ YAZILMASI
Maddelerin birbiri içeresinde homojen olarak dağılmasına çözünme denir.
Sabit sıcaklık ve basınç koşullarında 1 L doygun çözeltide çözünmüş maddenin mol sayısına molar çözünürlük denir.
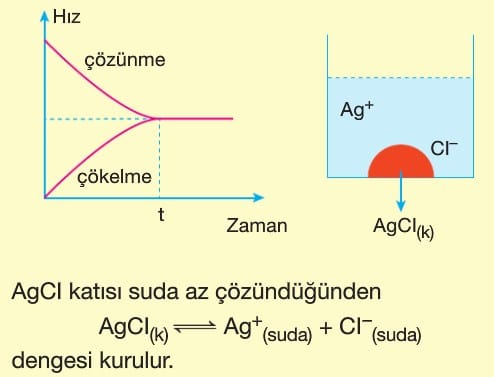
AgCI katısının suya atılıp çözünmesi ile hızlı bir şekilde Ag+ ve CI– iyonları oluşur. Bir süre sonra çözünme hızı azalır, çökelme hızı artar. Her iki hız eşitlendiğinde denge kurulur.
Yapısında,
Nitrat (NO–3) bulunan bileşiklerin tamamı
Hidroksit (OH–) bulunan alkali metallerin ve bazı toprak alkali metallerin bileşikleri
Amonyum (NH+4) bulunan bileşikler
Asetat (CH3COO–) bulunan tuzlar suda iyi çözünürler.
Çözünürlük çarpımı (Kçç), doygun bir çözeltideki iyon derişimlerinin çarpımıdır.
Belirli bir sıcaklıkta her katı madde için bir Kçç değeri vardır. Denge sabiti olduğundan sadece sıcaklıkla değişir.
Çözünürlük çarpımı (Kçç) ile katı maddenin çözünürlükleri bulunabilir ya da karşılaştırılabilir.
Çözünürlük Çarpımı Hesaplamaları:
Çözünürlük, doymuş çözeltiler için kullanılan bir kavramdır. Kçç yardımı ile doygun çözeltilerdeki molar çözünürlük değerleri bulunabilir.
Bileşiğin formülünü ve Kçç değerlerini bilmek hesaplamaları kolaylaştırır.
DOYMUŞLUK, DOYMAMIŞLIK VE ÇÖKELME
Çökelti oluşumu,
Çözücüye çözebileceğinden fazla çözünen eklenmesi ile
Farklı çözeltilerin karıştırıldığında bazı anyon ve katyonların birleşerek katı halde çözeltiden ayrılması ile gerçekleşir:
Çökelme olayının gerçekleşmesi için gerekli koşullardan biri de çözeltinin doygunluğa ulaşmış olmasıdır.
Belirli bir andaki iyon derişimlerinin çarpımı (Ki) ile çözünürlük çarpımı (Kçç) karşılaştırılarak çözeltinin durumu hakkında yorum yapılabilir.
Eğer,
Ki < Kçç ise çözelti doymamıştır ve çökelme olmaz.
Ki = Kçç ise çözelti doymuştur ve çökelme olmaz.
Ki > Kçç ise çözelti önce doyar sonra çökelme olur. Çökelme Ki = Kçç oluncaya kadar devam eder.