Bohr Atom Teorisi ve Modern Atom Teorisi 9. Sınıf Kimya
Bohr Atom Teorisi
Yüksek sıcaklığa kadar ısıtılan maddelerin yaydığı ışınlar, prizmadan geçirildiğinde farklı dalga boylarında ışınlara ayrılır. Bu şekilde kırmızıdan mora renge kadar kesintisiz bir spektrum elde edilir. Bu spektrumlara sürekli spektrum denir.
Gaz halindeki bir maddenin atomları ısıtıldığında ya da belirli enerjiye sahip ışın gönderildiğinde elektronlar yüksek enerjiden dolayı kararsız hale gelirler. Bu enerji fazlalığından kurtulmak için elektronlar ışıma yapar. Bu ışımalara prizmadan geçirildiğinde kesikli spektrumlar oluşur. Her atomun ışıma sonucunda farklı kesikli spektrumu oluşur. Bu spektrumlara yayınma (emisyon) çizgi spektrumu denir.
Bir maddeye gelen beyaz ışıktaki bazı ışınlar madde tarafından soğurulur. Soğurulan ışınlar, yayınma çizgi spektrumundaki dalga boylarına denk gelen siyah çizgiler oluşturur. Bu şekilde elde edilen spektrumlara soğurma (absorbsiyon) çizgi spektrumu denir.
Bohr Atom Teorisinin Eksiklikleri
- Bohr, tek elektronlu atom ve iyonların (H, 2He+, 3Li2+) çizgi spektrumlarını açıklayabilmişken, çok elektronlu taneciklerin çizgi spektrumunu açıklayamamıştır.
- Elektronların belirli bir yörüngede hareket etmediğini ve elektronların olasılık dağılımı olduğunu açıklayamaz.
- Elektronların parçacık özelliği yanında dalga özelliği de gösterdiğini göz önünde bulundurmamıştır.
- Nötrondan bahsetmez. Nötron 1932 yılında J. Chadwick tarafından bulunmuştur.
Bohr Atom Teorisine Göre
- Elektronlar çekirdek etrafında belirli enerjilere sahip yörüngelerde bulunur. Bu yörüngelere enerji düzeyi ya da katmanı da denir.
- Enerji düzeyleri 1, 2, 3, … gibi sayılarla gösterilebildiği gibi; K, L, M, N, … gibi harflerle de gösterilebilir.
- Atom çekirdeğinden uzaklaştıkça yörüngelerin sahip olduğu enerji miktarları artarken, yörüngeler arası enerji farkı ise azalmaktadır.
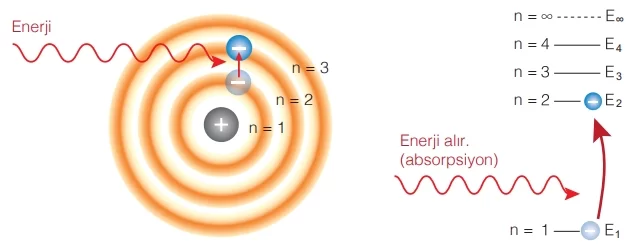
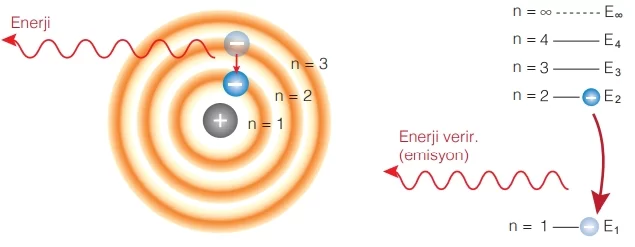
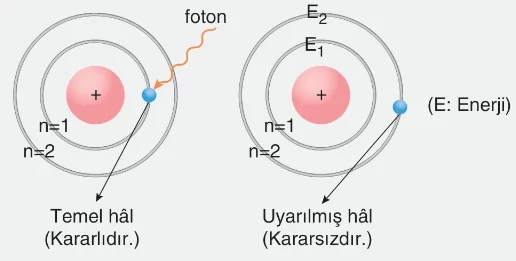
- Bir atomun elektronlarının en düşük enerjiye sahip yörüngede bulunmasına atomun temel hâli denir. Temel hâl, atomun kararlı hâlidir. Temel hâlde atom, belirli bir enerjiye sahip ışın gönderildiğinde ya da madde ısıtıldığında elektronları enerjiyi soğurarak (absorbsiyon) daha yüksek enerjili yörüngeye geçmesine atomun uyarılmış hâli denir. Uyarılmış hâl kararsızdır ve atom, aldığı enerjiyi yayıp (emisyon) tekrar temel hâline döner. Yayınlanan ışının enerjisi, yörüngeler arası enerji farkı kadardır.
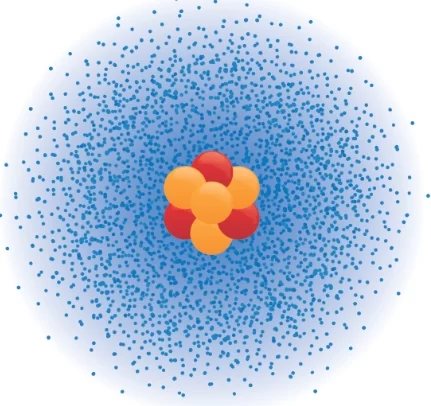
Modern Atom Teorisi (Bulut Modeli)
- Bohr atom teorisinin eksikliklerinden dolayı modern atom teorisi ortaya atılmıştır. Atomlardan daha küçük taneciklerin davranışlarını açıklamak üzere çalışmalar yapılmıştır. W. Heisenberg, elektronların konumlarının ve hızlarının aynı anda belirlenemeyeceğini kanıtlayıp, yörünge kavramını çürütmüştür. (Heisenberg belirsizlik ilkesi) Elektronların çekirdek etrafında bir bulut şeklindeki bölgelerde bulunabileceğini ortaya koymuştur.
- De Broglie, elektronların hem dalga hem de tanecik özelliği gösterdiğini ortaya koymuştur.
- Modern atom teorisinde E. Schrödinger, elektronların enerjilerini ve davranışlarını açıklayan dalga denklemini geliştirmiştir.
- Elektronların bulunma ihtimalinin yüksek olduğu bölgelere orbital (elektron bulutu) denir. Bir orbital en fazla 2 elektron alabilir. s, p, d ve f olmak üzere 4 farklı orbital türü vardır.
- Modern atom teorisinde enerji düzeyine enerji kabuğu denir.

Bohr Atom Modeli ve Modern Atom Teorisi Arasındaki Farklar
| Konu | Bohr Atom Modeli | Modern Atom Teorisi (Bulut Modeli) |
|---|---|---|
| Elektronların Yörüngeleri | Elektronlar, çekirdek etrafında sabit dairesel yörüngelerde dönerler. | Elektronlar sabit yörüngelerde değildir, belirli olasılıkla orbital adı verilen bölgelerde bulunurlar. |
| Elektronların Konumu | Elektronlar yörüngeler üzerinde tam olarak belirlenmiş konumlarda bulunur. | Elektronların tam konumu belirlenemez, sadece bulunma olasılıkları tahmin edilir. |
| Enerji Seviyeleri | Elektronlar, belirli enerji seviyelerine sahip yörüngelerde bulunur. | Elektronların enerji seviyeleri kesin değildir, enerji alt seviyeleri (alt kabuklar) mevcuttur. |
| Elektronların Hareketi | Elektronlar sabit hızla çekirdek etrafında dönerler. | Elektronlar dalga-parçacık özelliği gösterir, hareketleri belirsizlik ilkesine göre tahmin edilir. |
| Nötronun Varlığı | Nötronun varlığından bahsetmez. | Nötronların varlığı kabul edilir ve çekirdek yapısına dahil edilir. |
| Atom Yapısı | Çekirdek, pozitif yükle dolu olup, elektronlar belirli yörüngelerde hareket eder. | Çekirdek küçük ve pozitif yüklü, elektronlar ise olasılıkla çekirdek etrafındaki orbitallerde bulunur. |
| Modelin Geometrisi | Atom, sabit yörüngelere sahip dairesel bir yapıya sahiptir. | Atom, çekirdek etrafında elektronların bulut gibi dağıldığı bir yapıya sahiptir. |
| Elektronların Enerji Geçişleri | Elektronlar, düşük enerjili bir yörüngeden yüksek enerjili bir yörüngeye geçebilir. | Elektronlar, orbitaller arasında enerji seviyesine göre geçiş yapar, ancak bu geçişler belirli olasılıklarla olur. |
Çözümlü Örnek Sorular:
Soru 1:
Bohr atom modeline göre, elektronlar çekirdek etrafında hangi şekilde hareket eder?
A) Düz bir çizgide
B) Rastgele
C) Belirli yörüngelerde
D) Serbestçe
Çözüm:
Bohr atom modeline göre, elektronlar çekirdek etrafında belirli enerji seviyelerine karşılık gelen dairesel yörüngelerde hareket eder. Bu yörüngelere “enerji seviyeleri” denir.
Sonuç: C) Belirli yörüngelerde
Soru 2:
Bohr atom modeline göre bir elektron, enerji seviyesinden enerji yayarak daha düşük bir enerji seviyesine geçerse, aşağıdaki olaylardan hangisi gerçekleşir?
A) Elektron tamamen atomdan ayrılır.
B) Enerji seviyeleri değişmez.
C) Elektron, foton yayarak enerji kaybeder.
D) Atomun enerji seviyesi artar.
Çözüm:
Bohr atom modeline göre, bir elektron daha düşük bir enerji seviyesine geçerken enerji kaybeder ve bu kayıp bir foton yayılmasıyla olur.
Sonuç: C) Elektron, foton yayarak enerji kaybeder.
Soru 3:
Modern atom teorisine göre elektronlar tam olarak belirli bir yörüngede mi bulunur?
A) Evet, belirli yörüngelerde hareket eder.
B) Elektronlar serbestçe hareket eder.
C) Elektronların yerleri olasılıkla belirlenir.
D) Elektronlar sadece çekirdekte bulunur.
Çözüm:
Modern atom teorisine göre, elektronların tam olarak hangi yörüngede bulunduğunu kesin olarak belirlemek mümkün değildir. Elektronların bulunma olasılığı yüksek olan bölgeler “elektron bulutu” olarak adlandırılır.
Sonuç: C) Elektronların yerleri olasılıkla belirlenir.
Soru 4:
Bohr atom modeline göre, elektronların enerji seviyeleri ile modern atom teorisindeki elektron bulutları arasındaki fark nedir?
A) Bohr modelinde elektronlar sabit yörüngelerde, modern atom teorisinde ise olasılık bölgelerinde bulunur.
B) İkisi de sabit yörüngelere dayalıdır.
C) Bohr modelinde elektronlar serbest hareket eder, modern atom teorisinde sabittir.
D) Bohr modelinde sadece bir enerji seviyesi vardır, modern atom teorisinde birden fazla.
Çözüm:
Bohr modelinde elektronlar sabit yörüngelerde hareket ederken, modern atom teorisinde elektronlar olasılık bölgelerinde, yani “elektron bulutlarında” bulunurlar.
Sonuç: A) Bohr modelinde elektronlar sabit yörüngelerde, modern atom teorisinde ise olasılık bölgelerinde bulunur.
Soru 5:
Aşağıdakilerden hangisi modern atom teorisinin Bohr atom teorisinden farklarından biridir?
A) Bohr teorisi, elektronların belirli yörüngelerde hareket ettiğini belirtir.
B) Modern atom teorisi, elektronların belirli enerji seviyelerinde bulunduğunu reddeder.
C) Modern atom teorisi, elektronların bulunma olasılıklarının olduğu bölgeleri tanımlar.
D) Bohr teorisi, elektronların belirli bir hıza sahip olduğunu belirtir.
Çözüm:
Modern atom teorisi, elektronların belirli yörüngelerde değil, olasılık bulutlarında bulunduğunu belirtir. Elektronların tam yerini belirlemek mümkün değildir, ancak bulunma olasılığı yüksek olan bölgeler vardır.
Sonuç: C) Modern atom teorisi, elektronların bulunma olasılıklarının olduğu bölgeleri tanımlar.