Bağ Enerjileri 11. sınıf kimya
Aynı veya farklı atomlar arasında elektronların ortaklaşa kullanımı veya elektron alışverişi ile oluşan çekim kuvvetine kimyasal bağ denir. İki atom arasında bağ oluşumu atomların kararlılıklarını artırdığı için dışarıya ısı verir. İki atom arasındaki bağı koparmak için enerji verilmesi gerekir.
İki atom arasındaki bağı kırmak için verilmesi gereken enerjiye bağ enerjisi denir. İki atomun bir araya gelerek bağ oluşturması ile açığa çıkan enerji bağı kırmak için verilmesi gereken enerji ile aynıdır. Bağı koparmak için verilmesi gereken enerji ne kadar fazla ise bağ o kadar sağlam ve kararlıdır.
Br2 molekülündeki bağı koparmak için verilmesi gereken enerji I2 ninkinden fazla olduğu için Br – Br bağı daha sağlam ve kararlıdır. Bağ koparmak endotermik, bağ oluşumu da ekzotermik bir olaydır. Tepkime entalpisi tepkimeyi başlatmak için (ileri aktivasyon enerjisi) verilmesi gereken enerji ile başladıktan sonra dışarıya verdiği (geri aktivasyon enerjisi) enerji arasındaki fark olduğuna göre, tepkime entalpisini,
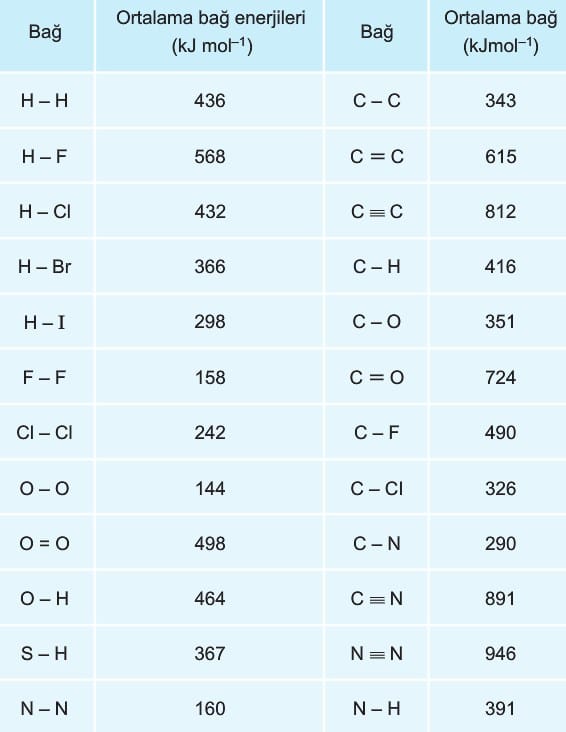
şeklinde hesaplayabiliriz. Bazı elementler arasındaki bağ enerjileri aşağıdaki tabloda verilmiştir.
Çözümlü Örnek Test Soruları
Bağ Enerjileri
Bağ enerjileri, kimyasal bağların kırılması veya oluşması sırasında açığa çıkan veya soğurulan enerji miktarını ifade eder. Bağ enerjileri, kimyasal reaksiyonların entalpi değişimini hesaplamada önemli bir rol oynar.
1. CH₄ molekülündeki C-H bağını kırmak için 413 kJ/mol enerji gerekmektedir. Bu enerji değeri neyi ifade eder?
A) C-H bağının kopması için gereken enerji miktarını
B) C-H bağının oluşumu sırasında açığa çıkan enerji miktarını
C) Molekülün tüm bağlarının enerjisini
D) Tepkimenin toplam entalpi değişimini
Çözüm: Verilen enerji, CH₄ molekülündeki tek bir C-H bağının kırılması için gereken enerji miktarını ifade eder. Cevap A.
2. Aşağıdaki olaylardan hangisi bağ enerjisi kavramı ile ilgilidir?
A) Bir tepkime sırasında bağların kırılması ve yeni bağların oluşması
B) Bir maddenin çözünmesi sırasında enerji alışverişi
C) Sadece ürünlerin oluşumu sırasında enerji açığa çıkması
D) Reaktanların reaksiyona girmeden önceki durumları
Çözüm: Kimyasal reaksiyonlarda bağların kırılması ve yeni bağların oluşumu bağ enerjisi ile ilgilidir. Cevap A.
3. H₂(g) + Cl₂(g) → 2 HCl(g) tepkimesi sırasında 432 kJ/mol enerji açığa çıkmıştır. Bu enerji ne anlama gelir?
A) H-Cl bağının oluşumu sırasında açığa çıkan enerji miktarıdır.
B) H-H bağının kırılması için gereken enerjidir.
C) Cl-Cl bağının kırılması için gereken enerjidir.
D) H₂ ve Cl₂ gazlarının toplam bağ enerjisidir.
Çözüm: Verilen enerji, HCl molekülündeki H-Cl bağının oluşumu sırasında açığa çıkan enerji miktarıdır. Cevap A.
4. CO₂ molekülü için C=O bağ enerjisi 799 kJ/mol’dür. CO₂ molekülünün tüm bağlarını kırmak için toplamda ne kadar enerji gerekmektedir?
A) 799 kJ
B) 1598 kJ
C) 399 kJ
D) 1200 kJ
Çözüm: CO₂ molekülü iki C=O bağı içerir, bu nedenle toplam bağ enerjisi 799 kJ/mol x 2 = 1598 kJ’dür. Cevap B.
5. Bir kimyasal tepkime sırasında ürünlerin bağ enerjileri reaktanlardan daha düşükse bu tepkimenin entalpi değişimi ne olur?
A) Ekzotermik, ısı açığa çıkar.
B) Endotermik, ısı soğurulur.
C) Tepkime gerçekleşmez.
D) Reaktanlar daha az enerji içerir.
Çözüm: Ürünlerin bağ enerjisi reaktanlardan düşükse, enerji açığa çıkar ve tepkime ekzotermiktir. Cevap A.
6. Aşağıdaki kimyasal tepkimelerden hangisinde bağ enerjileri dikkate alınarak tepkimenin endotermik olduğu söylenebilir?
A) Bağların kopması sırasında enerji soğuruluyorsa.
B) Bağların oluşması sırasında enerji açığa çıkıyorsa.
C) Tepkime sırasında toplam enerji azalıyorsa.
D) Reaktanların bağ enerjileri ürünlerden düşükse.
Çözüm: Bağların kopması sırasında enerji soğurulur ve bu da endotermik bir tepkimeyi gösterir. Cevap A.