Atomun Kuantum Modeli 11.Sınıf Kimya
Atomun Kuantum Modeli
Kuantum Sayıları
Modern Atom Teorisi’ne göre bir atom, atom çekirdeği etrafındaki enerji seviyeleri ve bu seviyelerdeki orbitallerde hareket eden elektronlardan oluşur. Elektronların atom çekirdeği etrafında bulunma olasılığının yüksek olduğu bölgelere orbital adı verilir. Orbitaller ve
elektronları kuantum sayılarıyla (n, l, ml, ms) ifade edilir.
Baş Kuantum Sayısı (n)
Elektronun bulunduğu enerji seviyesini (katmanı) belirten kuantum sayısıdır. Baş kuantum sayısı pozitif tam sayı değerlerini alır. Atomdaki enerji seviyeleri bu sayılarla veya harflerle aşağıdaki gibi gösterilebilir.
n=1,2,3,4…veya n=K,L,M,N…
Açısal Momentum Kuantum Sayısı (l)
Elektronun bulunduğu orbitalin türünü belirten kuantum sayısıdır. Açısal momentum kuantum sayısı baş kuantum sayısı n’ye bağlı olarak n — 1’e kadar olan tam sayılardan oluşur. Orbital türleri bu sayılarla veya harflerle aşağıdaki gibi gösterilebilir.
l= 0,1,2,3…veyal= s,p,d,f…
Manyetik Kuantum Sayısı (ml)
Orbital sayısını yani bir orbitalden kaç tane olduğunu belirten kuantum sayısıdır. Manyetik kuantum sayısı açısal momentum kuantum sayısına (4) bağlı olarak — l ile +£ arasındaki tam sayı değerlerini alır. Bir orbitalin kaç tane manyetik kuantum sayısı değeri varsa, o orbitalden o kadar vardır. Örneğin.

Spin Kuantum Sayısı (ml)
Bir orbitaldeki iki elektronun kendi eksenleri etrafındaki dönme yönleri birbirine zıttır. Bu dönme yönleri spin kuantum sayısıyla veya oklarla ![]() şeklinde belirtilir. Atomun ilk dört enerji seviyesinde (katmanında) bulunan orbitallerin kuantum sayıları ve bu orbitallerin gösterilişi aşağıdaki tabloda özetlenmiştir.
şeklinde belirtilir. Atomun ilk dört enerji seviyesinde (katmanında) bulunan orbitallerin kuantum sayıları ve bu orbitallerin gösterilişi aşağıdaki tabloda özetlenmiştir.
Orbitallerin Şekilleri
Orbitallerin kesin şekilleri olmasa da belirli şekillere sahip oldukları varsayılır. Orbitalin türüne göre şekli, büyüklüğü ve çekirdekten uzaklığı değişir.
Bir orbitalin baş kuantum sayısı artarsa büyüklüğü artar, fakat şekli değişmez.
Örneğin baş kuantum sayısı büyük olan 2s orbitali 1s orbitalinden daha büyük ve çekirdekten daha uzaktır. Fakat bu iki orbitalin şekilleri aynıdır. Aşağıdaki tabloda atomun ilk üç enerji seviyesini oluşturan s, p ve d orbitallerinin şekilleri ve özellikleri ayrıntılı olarak açıklanmıştır.
1.4 – Orbitallerin Enerjileri
Farklı orbitallerin enerjileri birbirinden farklıdır. Bu durum atom çekirdeği ile elektronlar arasındaki çekme kuvvetleri ve elektronlar
arasındaki itme kuvvetlerinden kaynaklanır. Kletchkowski-Madelung kuralına göre bir orbitalin enerjisi, orbitalin baş kuantum sayısı (n) ve açısal momentum kuantum sayısının (l) değerleri toplamına (n + 4) bağlıdır.
Bu kurala göre,
n + l değeri büyük olan bir orbitalin enerjisi daha fazladır.
n + l değerleri aynı olan orbitallerden n değeri büyük olanın enerjisi daha yüksektir.
Örneğin 2s, 3d, 4p, 4f orbitallerinin n + l değerleri toplamı aşağıdaki tabloda verilmiştir.
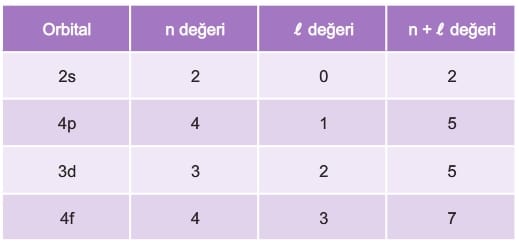
Tablodaki n + l değerlerine göre, değerin en büyük olduğu 4f orbitalinin enerjisi en yüksek, değerin en küçük olduğu 2s orbitalinin enerjisi en düşüktür. n +l değerleri toplamları eşit olan 4p ve 3d orbitallerinden n değeri büyük olan 4p orbitalinin enerjisi 3d orbitalinden daha büyük olur.
Buna göre bu orbitallerin enerjileri küçükten büyüğe doğru 25, 3d, 4p, 4f şeklinde sıralanabilir.
Çözümlü Örnek Test Soruları
Atomun kuantum modeli, elektronların yerleşimi ve atomun enerji seviyeleri ile ilgilidir. Bu modelde elektronların yörüngeleri ve enerjileri kuantum sayıları ile tanımlanır.
1. Aşağıdaki kuantum sayılarından hangisi elektronun enerji seviyesini belirler?
A) Baş kuantum sayısı
B) Açısal momentum kuantum sayısı
C) Manyetik kuantum sayısı
D) Spin kuantum sayısı
Çözüm: Elektronun enerji seviyesini belirleyen kuantum sayısı, baş kuantum sayısıdır. Cevap A.
2. Bir atomdaki 3. enerji seviyesinde en fazla kaç elektron bulunabilir?
A) 8
B) 10
C) 18
D) 32
Çözüm: Elektronların enerji seviyeleri formülü 2n² ile hesaplanır. n = 3 olduğunda 2 x 3² = 18 elektron bulunabilir. Cevap C.
3. Elektronların bir orbitalde zıt spinlere sahip olmasını belirten kuantum sayısı hangisidir?
A) Manyetik kuantum sayısı
B) Spin kuantum sayısı
C) Baş kuantum sayısı
D) Açısal momentum kuantum sayısı
Çözüm: Elektronların spinlerini belirleyen kuantum sayısı spin kuantum sayısıdır. Cevap B.
4. 2. enerji seviyesindeki d orbitali kaç yönelime sahiptir?
A) 1
B) 3
C) 5
D) 7
Çözüm: d orbitalleri her zaman 5 yönelime sahiptir. Cevap C.
5. Pauli dışarlama ilkesine göre, aynı orbitale ait iki elektronun hangi özellikleri farklıdır?
A) Enerji seviyeleri
B) Baş kuantum sayıları
C) Spin kuantum sayıları
D) Manyetik kuantum sayıları
Çözüm: Pauli dışarlama ilkesine göre aynı orbitale ait iki elektronun spin kuantum sayıları farklıdır. Cevap C.
6. Bir atomun elektron diziliminde en yüksek enerji düzeyindeki elektronları hangi kuantum sayısı tanımlar?
A) Baş kuantum sayısı
B) Açısal momentum kuantum sayısı
C) Manyetik kuantum sayısı
D) Spin kuantum sayısı
Çözüm: Elektronun enerji düzeyini baş kuantum sayısı belirler. Cevap A.