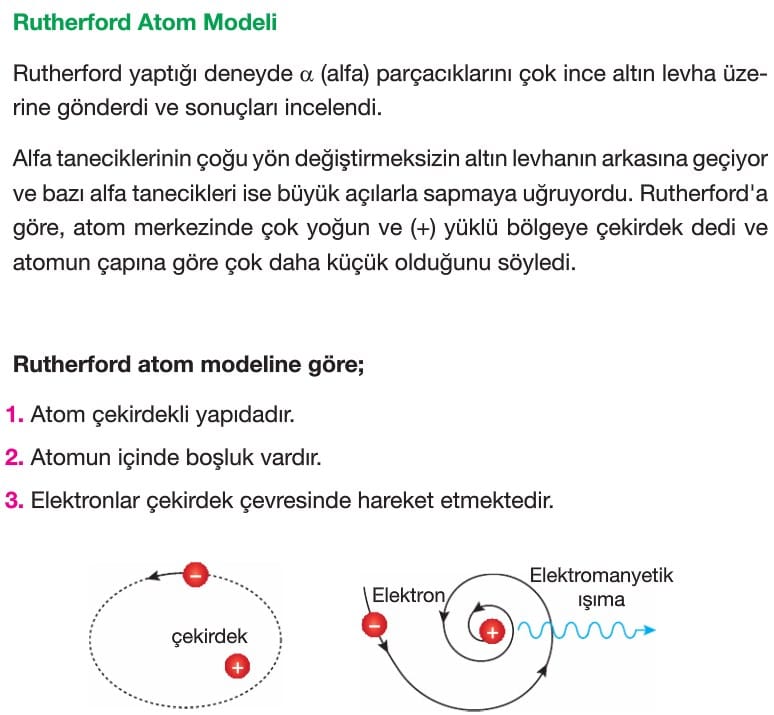
Atomun (Atom Modellerinin) Tarihsel Gelişimi Fizik Ayt
ATOM KAVRAMININ TARİHSEL GELİŞİMİ
Elektronun Özellikleri
1800’lü yıllarda gerçekleştirilen deşarj tüpü deneylerinde katot ışınları keşfedildi. J.J. Thomson kurduğu düzenekte katot ışınlarının, yükü ve kütlesi olan çok küçük parçacıklar olduğunu ispatladı. Bu ışımalara elektron adı verilen parçacıklar sebep oluyordu. Ayrıca bu taneciklerin elektrik ve manyetik alanda sapmaları nedeniyle negatif yüklü olabilecekleri fikrine ulaştı.
Thomson elektronun atomun içindeki bir parçacık olduğunu düşünüyordu.
Bundan sonra elektronun yalnızca yükü ve yalnızca kütlesini hesaplamak için çalışmalar yapıldı. Robert Millikan yağ damlası deneyi olarak bilinen deneyi sonucunda, elektronun yükünü
Enerji Seviyeleri ve Franck — Hertz Deneyi
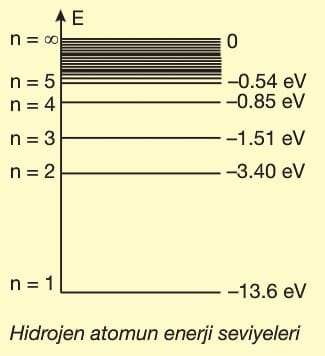
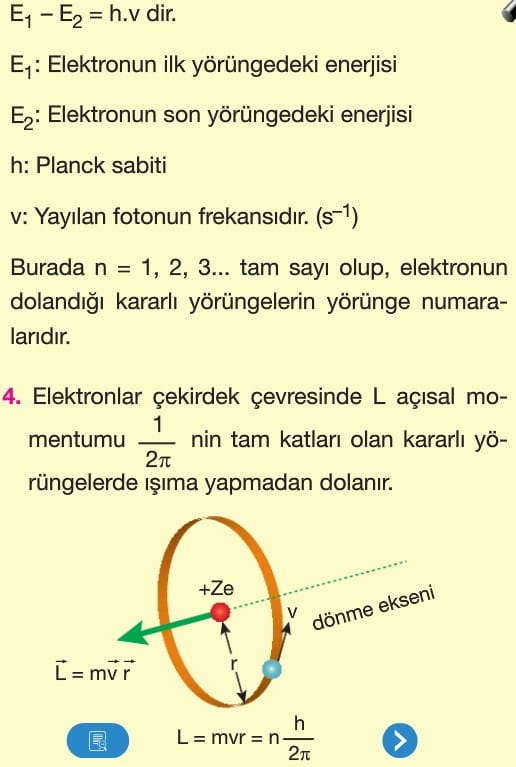
Elektronlar belirli yörüngelere ve bu yörüngelerde belirli enerjilere sahiptirler. Franck—Hertz deneyin—de, enerjileri bilinen elektronlar gaz dolu odalarda atomlarla çarpıştırılmış ve çarpışma sonucunda elektronların enerji kaybetmeleri sağlanmıştır.
Odayı terkeden elektronların enerjileri ölçülmüş ve elektronların ya hiç enerji kaybetmedikleri ya da sadece belirli değerlerde enerji kaybettikleri gözlenmiştir.
Bu deneyle ulaşılan sonuçlara göre;
1. Atomların iç enerjilerindeki değişimler sadece belirli miktarlarda olur.
2. Bir atomun alabileceği en küçük enerji miktarına birinci uyarılma enerjisi veya birinci enerji düzeyi denir.
3. Herhangi bir enerji almamış bir atomun içinde bulunduğu normal duruma temel hâl (durum) denir.
4. Atomlara çarpan elektronların enerji, birinci uyarılma enerjisinden küçükse uyarılma gerçekleşmez.
Atomun Uyarılması
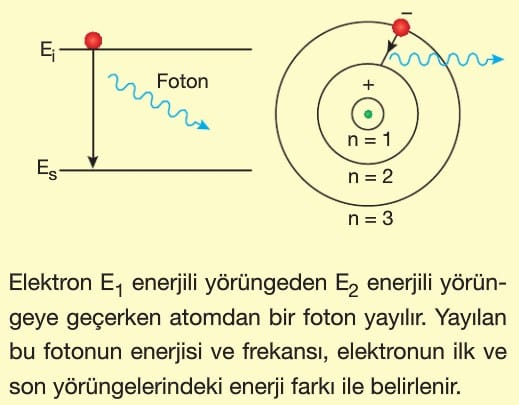
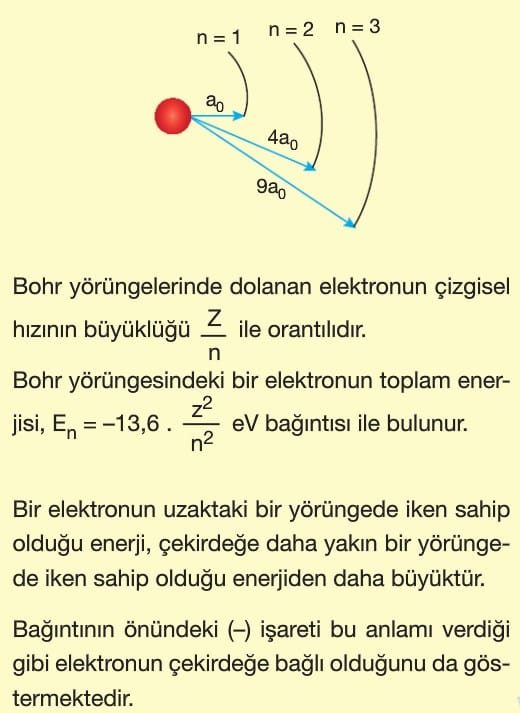
Atomun uyarılması, atoma enerji verilmesi demektir. Bu ise elektronların daha üst yörüngelere çıkarılması demektir.
Atomun enerji almamış hâline temel hâl denir. Enerji alan atomun elektronu temel hâlden daha üst yörüngeye geçer. Atom kararlı hâlde olma isteğinden 10-8 saniyede temel hale geri dönerken aldığı bu fazla enerjiyi foton salarak yani ışıma yaparak geri verir. Atom 4 yolla uyarılır.
1. Isıtılarak
2. Atomların birbiriyle çarpıştırılması
3. Elektronlarla bombardıman edilmesi
4. Fotonlarla uyarma
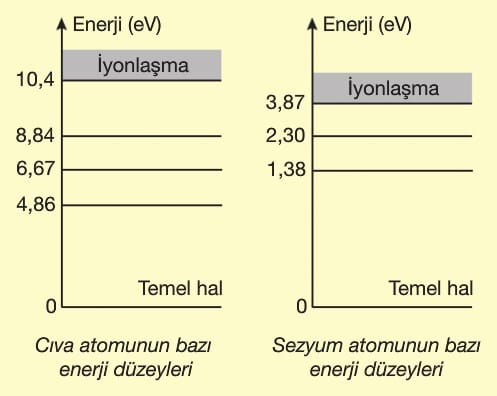
Elektronun atomu uyarabilmesi için elektronun enerjisi, atomun en az 1. uyarılma enerjisine eşit veya daha büyük olması gerekir. Fotonlarda ise durum farklıdır. Fotonun enerjisi atomun herhangi bir uyarılma enerjisine ancak eşit olduğu zaman atom uyarılır ve foton enerjisinin tamamını atoma verir. Fotonun enerjisinin bölünmeyeceği unutulmamalıdır.
Modern Atom Teorisi
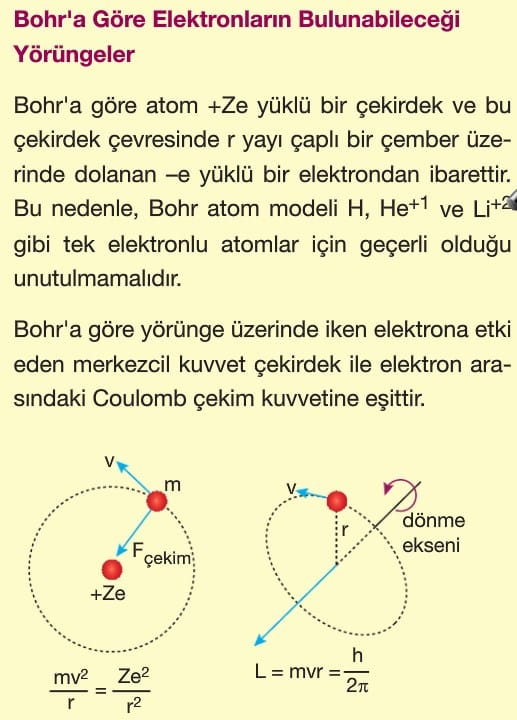
Modern atom teorisi günümüzde de kabul edilen en gelişmiş atom modelidir. Bohr atom modelinden sonra günümüzde geçerliliğini koruyan atom teorisidir. Bohr Atom Modeli, elektronların hareketini klasik fizik yasalarına göre açıkladı. Klasik fizikte elektronlar tanecik özelliği gösteren ve çekirdek etrafında elektrostatik kuvvetler etkisinde dönen parçacıklardı.
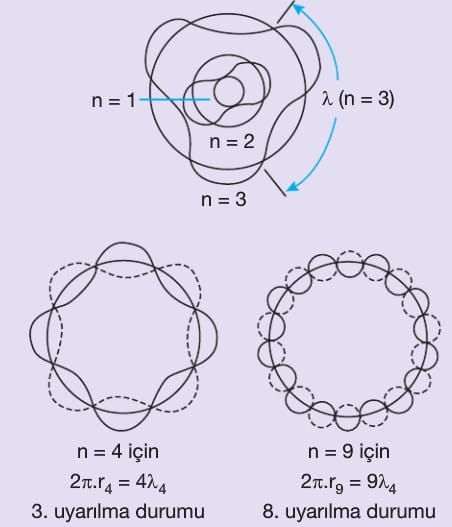
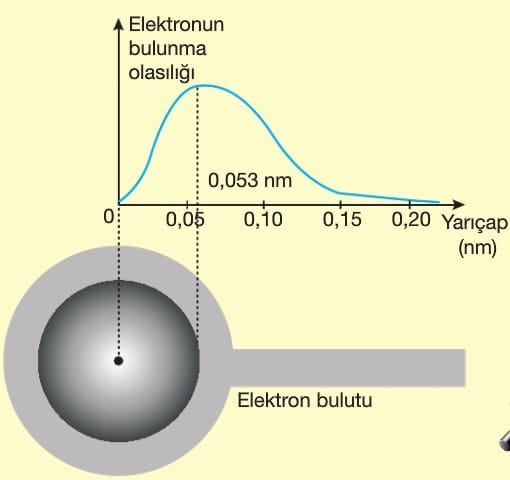
Bu teorinin Bohr atom modelinden en önemli farkı elektronların çekirdeğin etrafında çizgisel yörüngelerde dolandığını söylemesi veya konumlarının belirli yerlerde olmamasıdır. Elektronlar çok hızlı hareket ederler ve bu nedenle elektronların yeri saptanamaz ancak bulunma olasılıklarının yüksek olduğu yerler belirlenebilir. Bu alanlara elektron bulutu denir. Bu teorinin bulunmasına A.Einstein, W.Heisenberg, M.Planck ve R.Feynman katkıda bulunmuştur.
Schrödinger Dalga Denklemi
Schrödinger denklemi olayların veya olayların sonuçlarının bir dalga fonksiyonu cinsinden ifade edildiği bir eşitliktir.
Bugünkü fizikte modern alıştırmaların hemen hemen tamamı bu denkleme dayanır. Bu denklem elektronun belirli bir anda nerede olacağını değil orada olma ihtimalinin ne olduğu hakkında bilgi verir. Elektronun konumundan tam olarak söz etmek mümkün değildir. Schrödinger denkleminden sonra Bohr’a göre elektronların sınırlı bölgede hareket etmedikleri daha net olarak anlaşılmıştır.