Atomların Bağ Yapma Kapasiteleri Kimya Tyt
ATOMLARIN BAĞ YAPMA KAPASİTELERİ
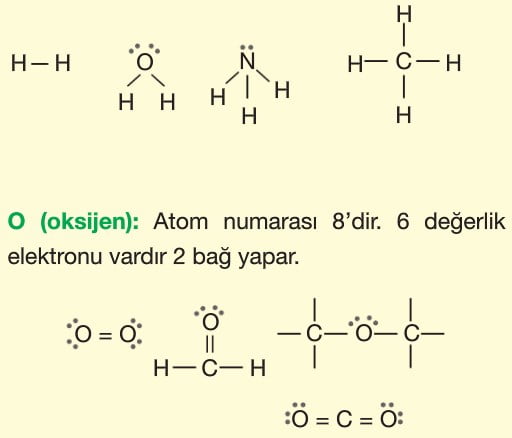
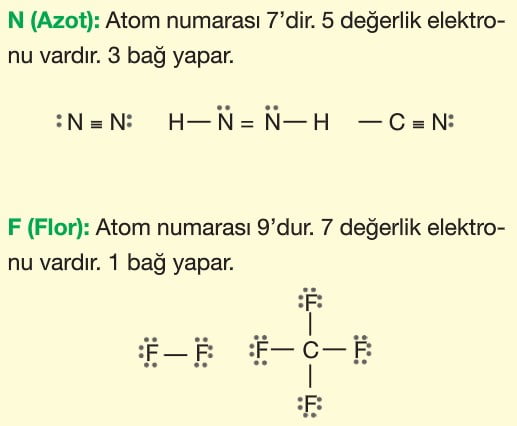
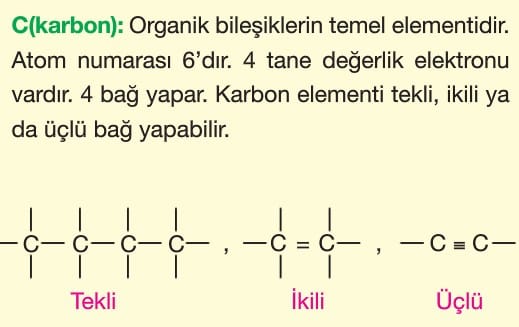
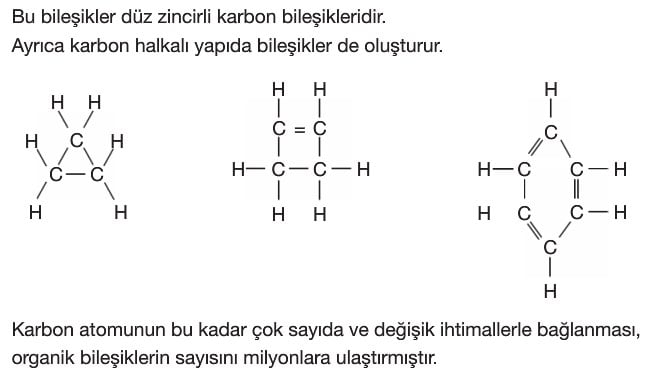
Atomları bir arada tutan kuvvetlere kimyasal bağ (güçlü etkileşim) denir. Kimyasal bağlar değerlik elektronlarının alışverişi ya da ortaklaşa kullanılmasıyla oluşur. Bu durumla atomlar, en kararlı hâl olan soygazlara benzemeye çalışırlar. Değerlik elektronlarını 2’ye tamamlayanlar helyum soygazına benzerler (dublet kuralı). Değerlik elektronlarını 8’e tamamlayanlar diğer soygazlara benzerler (oktet kuralı).
Atomların bağ yapma özellikleri şu şekildedir.
H (hidrojen): Atom numarası 1’dir. 1 değerlik elektronu vardır. Bir bağ yapar.
Hidrokarbonlar
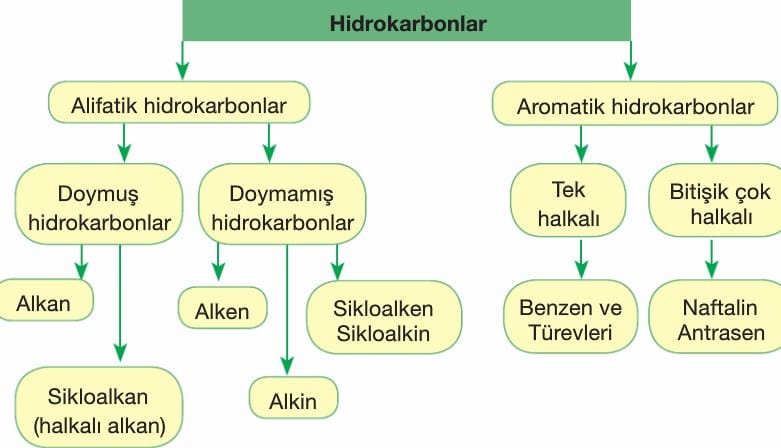
Hidrokarbonlar, yapılarında sadece karbon ve hidrojen atomları içeren organik bileşik türüdür. Alifatik ve aromatik hidrokarbonlar olarak ikiye ayrılır.
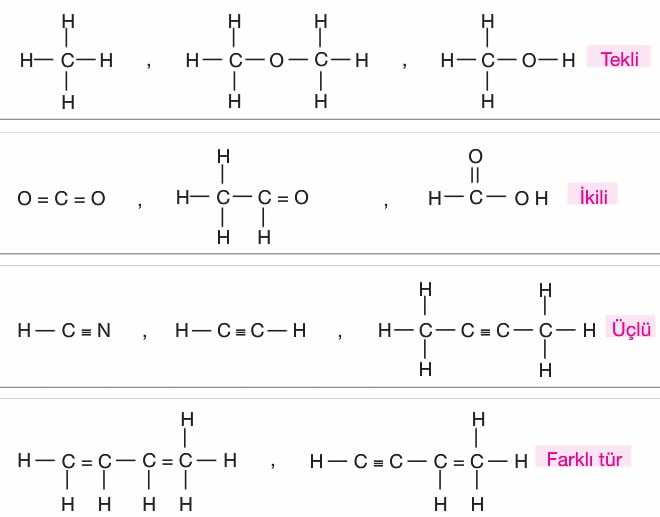
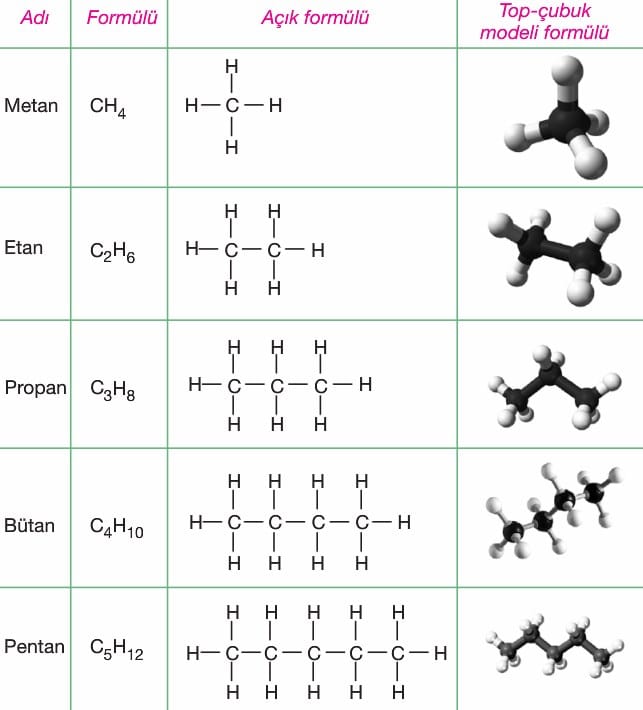
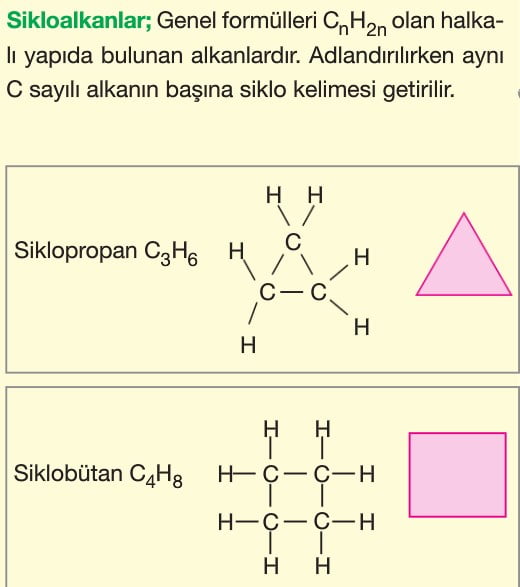
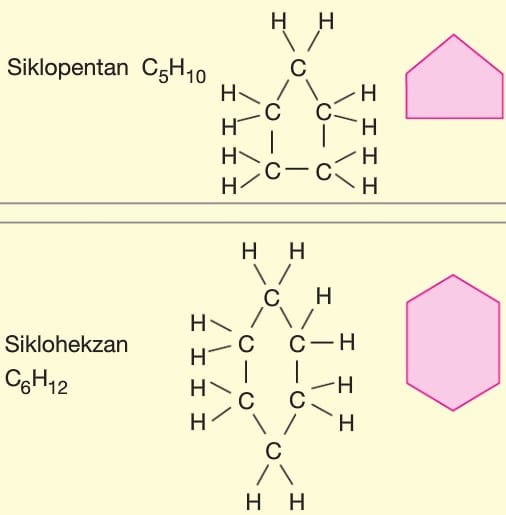
Alkanlar (Parafinler): Karbonun tekli bağ yaptığı doymuş hidrokarbon grubudur. Bu gruba. tepkimelere ilgisiz anlamında parafinlerde denir. Doymuş hidrokarbonların kapalı formülü CnH2n+2 dir.
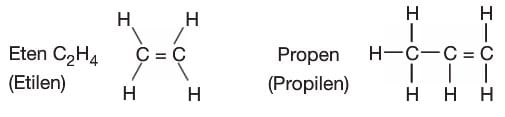
Alkenler: Yapısında en az bir tane karbon-karbon çifte bağı bulunduran hidrokarbonlardır. Genel formülleri CnH2n’dir. Alkanlarda -an eki yerine -en ya da -ilen eki getirilerek adlandırılır. Alkenler doymamış hidrokarbonlardır. İlk üyeleri iki karbonludur.
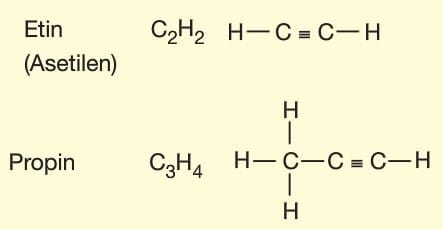
Alkinler (Asetilenler): Yapısında en az bir tane karbon-karbon üçlü bağ bulunduran hidrokarbonlardır. Genel formülleri CnH2n-2,dir. Alkanlarda -an son ekinin yerine -in son eki getirilerek adlandırılırlar. Alkinler doymamış hidrokarbonlardır. İlk üyesi iki karbonludur.
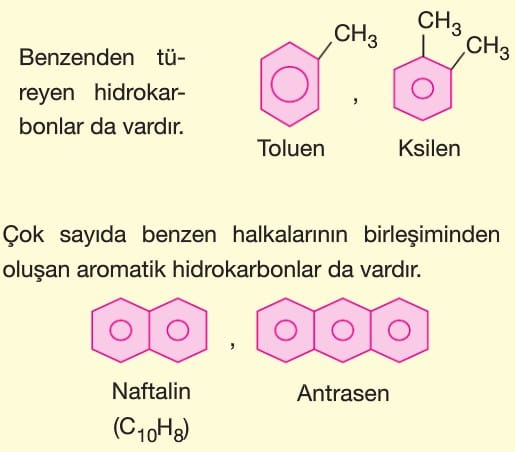
Aromatik Hidrokarbonlar (Arenler)
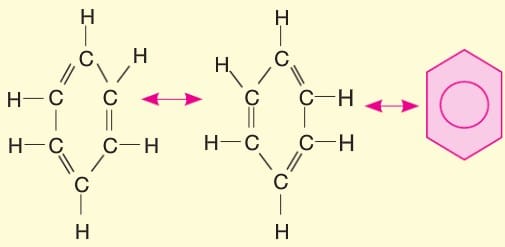
Genellikle halkaları altı tane atomdan oluşur. En basit üyesi altı karbonlu C6H6 formülüyle gösterilen benzendir.
Bu yapıda ikili bağların yerleri sabit değildir. Bağı oluşturan elektronlar sürekli yer değiştirmektedir. Bu olaya rezonans denir.