Atomlarda Elektron Dağılımı 9. Sınıf Kimya
Atomlarda Elektron Dağılımı
Çok elektronlu atomlarda, birden fazla elektronun varlığı atom orbitallerinin bağlı olduğu enerji seviyelerini büyük ölçüde etkiler. Atomların proton sayısının artması, 2s ve 2p orbitalleri arasındaki enerji farkının büyümesine neden olur. Bu durum, elektronlar arasındaki itmelerin artmasından kaynaklanır. Elektron itişimleri, aynı kabuk içindeki farklı alt kabukların farklı enerji seviyelerine sahip olmasına yol açar.
Çok elektronlu atomlarda orbitallerin enerji sıralaması genel olarak şu şekildedir:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f…
Bu sıralama, atomların elektron dağılımını belirler. Belirli bir alt kabuktaki orbitaller (örneğin, 3p orbitalleri) aynı enerji seviyesine sahiptir. Orbitallerin enerjileri ve aralıkları bir atomdan diğerine değişiklik gösterebilir.
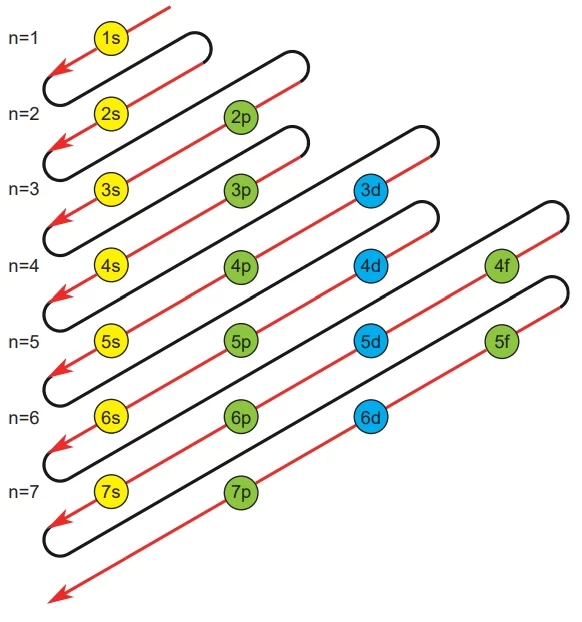
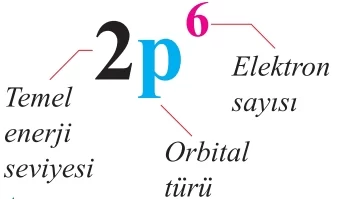
Belirlenen orbital enerji sıralamasına göre, atomdaki elektronların orbitallerdeki yerleşimini göstermek için iki farklı yöntem bulunmaktadır. Bunlardan ilki elektron dağılımı (konfigürasyonu) olarak adlandırılır. Bu yöntemde, orbitalin bulunduğu temel enerji seviyesi ile orbital türü yazılır ve orbitaldeki elektron sayısı üst simge olarak belirtilir.
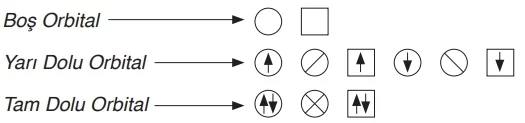
Atomların elektron dağılımı, orbital şeması kullanılarak görselleştirilebilir. Bu şemada, orbitalleri geometrik şekiller temsil ederken, şekillerin içindeki semboller elektronları ifade eder. Boş, yarı dolu ve tam dolu orbitaller farklı şekillerle aşağıdaki gibi gösterilir:
Periyodik tabloda bulunan atomlardaki orbitallerin gerçek enerjileri ve elektronların atom orbitallerine yerleşimindeki sıralama, genellikle spektroskopik ve manyetik yöntemler gibi deneysel çalışmalara dayanarak belirlenebilir. Ancak, birçok atom için elektron dağılımı, atom orbitallerinin enerji sıralamasıyla ilgili kurallar (Aufbau ilkesi, Pauli dışlama ilkesi ve Hund kuralı) kullanılarak tahmin edilebilir.
Aufbau Kuralı:
- Elektronlar, atomda en düşük enerjiye sahip orbitalden başlayarak yerleştirilir.
- Çok elektronlu atomlarda orbitallerin enerji sıralaması şu şekildedir:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < …
Aufbau kuralına göre elektronlar önce en düşük enerjiye sahip orbital olan 1s orbitalinden itibaren dolmaya başlar.
Pauli İlkesi:
- Bir atomdaki elektron diziliminde aynı özelliklere sahip iki elektron bulunamaz. Elektronlar aynı kabuk ve orbitalde bulunsalar bile spinleri farklı olmalıdır.
Pauli ilkesine göre, bir orbitalde bulunan iki elektronun zıt spinli olması gerekir. Bu kurala uyulmayan durumlar, elektron diziliminde hata olduğuna işaret eder.
Hund Kuralı:
Bir atomda elektronlar, aynı enerji düzeyindeki eşit enerjili orbitallere öncelikle aynı yönde birer birer yerleşir. Orbitaller yarı dolu hale geldikten sonra, zıt yönlü elektronlarla doldurulmaya başlanır. Hund kuralına göre, aynı enerji seviyesindeki orbitallerde her orbital bir elektron alana kadar ikili yerleşim yapılmaz.
Nötr Atomların Elektron Dizilimi:
| Orbital Türü | Orbital Sayısı | Alabileceği En Fazla Elektron Sayısı |
|---|---|---|
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Bir atomda elektronların orbitallere hangi sırayla yerleştirildiğine elektron dizilimi adı verilir. Bu dizilim, elektronların orbitallerde nasıl dağıldığını göstermek için orbital şeması ile de ifade edilebilir.
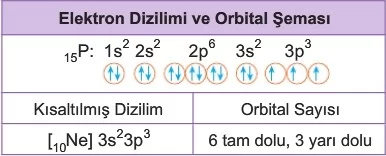
Atomlarda Elektron Dağılımı – Kısa Ders Notları (9. Sınıf)
- Elektron Dizilimi (Konfigürasyonu):
- Elektronlar, atom orbitallerine belirli kurallara göre yerleşir.
- Sıralama: 1s² → 2s² → 2p⁶ → 3s² → 3p⁶ → 4s² → 3d¹⁰…
- Aufbau İlkesi:
- Elektronlar, en düşük enerji seviyesinden başlayarak orbitallere yerleşir.
- Pauli Dışlama İlkesi:
- Aynı orbitalde bulunan iki elektronun spinleri zıt olmalıdır.
- Hund Kuralı:
- Aynı enerji seviyesindeki orbitaller önce tek elektron alır, sonra çiftlenir.
- Orbital Türleri:
- s orbitali: 2 elektron alır.
- p orbitali: 6 elektron alır.
- d orbitali: 10 elektron alır.
- Örnek Elektron Dizilimleri:
- Hidrojen (H): 1s¹
- Oksijen (O): 1s² 2s² 2p⁴
Çözümlü Örnek Sorular:
Soru 1:
Oksijen (O) atomunun elektron dağılımı nasıldır?
A) 2-8-6
B) 2-6
C) 2-8-7
D) 2-8-8
Çözüm:
Oksijenin atom numarası 8’dir. Bu nedenle oksijenin toplam 8 elektronu vardır. Elektron dağılımı önce birinci enerji seviyesine 2 elektron, ardından ikinci enerji seviyesine 6 elektron olacak şekilde düzenlenir.
Sonuç: B) 2-6
Soru 2:
Sodyum (Na) atomunun elektron dağılımı nasıldır?
A) 2-8-1
B) 2-7
C) 2-8-2
D) 2-8-8
Çözüm:
Sodyumun atom numarası 11’dir. Bu yüzden sodyumun 11 elektronu vardır. Elektron dağılımı birinci enerji seviyesine 2 elektron, ikinci enerji seviyesine 8 elektron ve üçüncü enerji seviyesine 1 elektron şeklinde olur.
Sonuç: A) 2-8-1
Soru 3:
Alüminyum (Al) atomunun elektron dağılımı nasıldır?
A) 2-8-3
B) 2-7-4
C) 2-8-4
D) 2-8-2
Çözüm:
Alüminyumun atom numarası 13’tür. Bu yüzden toplam 13 elektronu vardır. Elektronlar birinci enerji seviyesine 2, ikinci enerji seviyesine 8 ve üçüncü enerji seviyesine 3 elektron olacak şekilde dağılır.
Sonuç: A) 2-8-3
Soru 4:
Kükürt (S) atomunun elektron dağılımı nasıldır?
A) 2-8-6
B) 2-8-7
C) 2-6
D) 2-8-5
Çözüm:
Kükürdün atom numarası 16’dır. Toplam 16 elektronu vardır. Elektron dağılımı, birinci enerji seviyesine 2 elektron, ikinci enerji seviyesine 8 elektron ve üçüncü enerji seviyesine 6 elektron şeklindedir.
Sonuç: A) 2-8-6
Soru 5:
Atom numarası 20 olan kalsiyumun (Ca) elektron dağılımı nasıldır?
A) 2-8-8-2
B) 2-8-8-1
C) 2-8-7-3
D) 2-8-7-1
Çözüm:
Kalsiyumun atom numarası 20’dir. Bu nedenle toplam 20 elektronu vardır. Elektronlar birinci enerji seviyesine 2, ikinci enerji seviyesine 8, üçüncü enerji seviyesine 8 ve dördüncü enerji seviyesine 2 elektron olarak dağılır.
Sonuç: A) 2-8-8-2