Atom Teorileri ve Atomun Yapısı 9. Sınıf Kimya
ATOM TEORİLERİ VE ATOMUN YAPISI
ATOM TEORİLERİ
- Bilim insanları, madde ve yapısını anlamak için araştırmalar yapmış ve bu çalışmalar sonucunda çeşitli atom modelleri geliştirmişlerdir. Ülkemizde Türkiye Enerji, Nükleer ve Maden Araştırma Kurumu (TENMAK), hızlandırıcı teknolojisi laboratuvarında atom altı parçacıklara ait araştırmalara devam etmektedir.
- Atom modellerinin kronolojik sıralaması aşağıda verilmiştir.
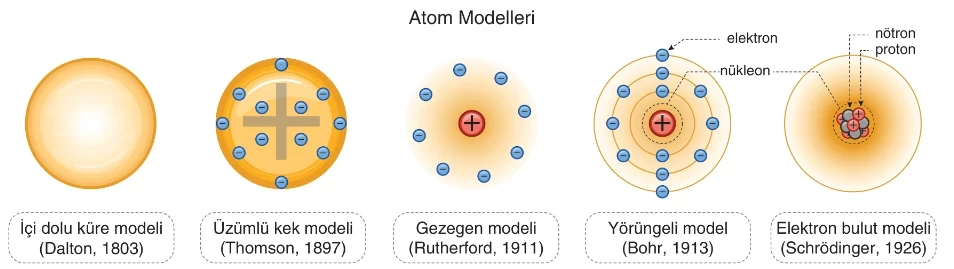
Dalton Atom Teorisi
Bilimsel olarak kabul edilen ilk atom teorisidir.
Dalton Atom Teorisine Göre
- Atomlar daha küçük parçalara ayrılmayan içi dolu kürelerdir.
- Aynı elementin atomları özdeş iken farklı elementlerin atomları da farklıdır.
- Bileşikler, atomların belirli bir oranda birleşmesi ile oluşur.
- Kimyasal olaylar, atomların yeniden kendi aralarında düzenlenmesi ile meydana gelir.
Dalton Atom Teorisinin Eksiklikleri
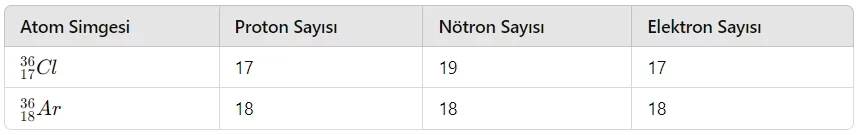
- Bir elementin bütün atomları aynı değildir. İzotop atomlar aynı elemente aittir.
- Atom büyük boşluklardan oluşur.
- Atom çekirdek tepkimeleri sonucunda parçalanabilir veya başka elementlerin atomlarına dönüşebilir.
- Atomun yapısında proton, nötron ve elektron gibi atom altı parçacıklar vardır.
Thomson Atom Teorisi (Üzümlü Kek Modeli)
Thomson, içi gaz dolu tüplere elektrik akımı uyguladığında bazı ışınları keşfetmiş ve bu ışınların negatif yüklü tanecikler olduğunu ve bu taneciklerin kütle/yük oranlarını bulmuştur.
Thomson Atom Teorisine Göre
- Atomun yapısında negatif ve pozitif yükler bulunur.
- Atom, yük bakımından nötrdür.
- Küre şeklinde olan atomların çapı yaklaşık 10⁻⁸ cm’dir.
- Atomun hacimce büyük kısmını pozitif yük oluşturur.
- Atomda negatif yüklü tanecikler, pozitif yüklü taneciklerin yer içerisine rastgele homojen bir şekilde dağılmıştır.
- Negatif yüklü tanecikler küresel pozitif yüklü tanecikler yanında çok küçüktür. Bundan dolayı atomun kütlesi, yaklaşık pozitif yükün kütlesine eşittir.
Thomson Atom Teorisinin Eksiklikleri
- Nötrondan bahsetmemiştir.
- Negatif yüklü tanecikler, pozitif yüklü tanecikler içerisinde rastgele dağılmamıştır.
- Atomun pozitif yükleri içeren çekirdeği ve boşluklu bir yapısı vardır.
- Atomdaki pozitif yüklü tanecikler, atomun kütlesinin yaklaşık yarısını oluşturur.
Rutherford Atom Teorisi (Gezegen Modeli)
Rutherford, radyoaktif radyum elementinden elde ettiği alfa (α) taneciklerini altın levha üzerine göndermiştir. Yaptığı deney sonucu α ışınlarının büyük bir kısmının sapmadan levhadan geçtiğini, çok az bir kısmının ya geri döndüğünü ya da saptığını gözlemlemiştir.
(Alfa (α) ışınları yüksek enerjili ![]() tanecikleridir.)
tanecikleridir.)
Rutherford Atom Teorisine Göre
- Atomdaki pozitif yüklerin tamamı, çok küçük olan çekirdek adı verilen merkezde bulunur.
- Pozitif yüklerin toplam kütlesi, atomun kütlesinin yaklaşık olarak yarısı kadardır.
- Atom büyük boşluklardan oluşur. Çekirdeğin çapı yaklaşık 10−1310^{-13} cm, atomun çapı ise yaklaşık 10−810^{-8} cm’dir.
- Atom, yük bakımından nötrdür.
- Elektronlar atomun çekirdeğinin etrafında bulunur.
Rutherford Atom Teorisinin Eksiklikleri
- Çekirdek etrafındaki elektronların yerlerini ve davranışlarını açıklayamamıştır.
- Atom çekirdeğinde yüksüz taneciklerin olduğunu söylemiş ancak ispatlayamamıştır.
- Elektronların neden çekirdeğe düşmediğini açıklayamamıştır.
Bohr Atom Teorisi ve Modern Atom Teorisi
ATOMUN YAPISI
Atomun Temel Tanecikleri
- Eski çağlardan bu yana, maddenin yapısı ve ne tür bileşenlerden meydana geldiği insanları hep meraklandırmıştır. Atom kavramını ilk kez dile getiren kişi ise antik dönem filozoflarından Demokritus’tur. Yunanca’da atomos kelimesi, “bölünemez” anlamına gelmektedir. Demokritus’a göre maddenin en temel yapı taşı atomdur.
- Atom, bir elementin kimyasal özelliklerini taşıyan en küçük birimdir. Bir atomun yapısında proton, nötron ve elektron gibi temel tanecikler bulunur.Proton, atomun çekirdeğinde yer alan pozitif yüklü parçacıktır.Elektron, atomun çekirdeğinin çevresinde dolanan negatif yüklü parçacıktır.
Nötron, atom çekirdeğinde bulunan ve herhangi bir elektrik yükü taşımayan taneciktir.
- Atom altı taneciklerin kütle ve yük değerleri aşağıda sunulmuştur.
| Tanecik | Bağıl Kütle (akb) | Kütle (gram) | Elektrik Yükü (Coulomb) | Bağıl Yük |
|---|---|---|---|---|
| Elektron | 0,0005486 | 9,109 × 10⁻²⁸ | −1,602 × 10⁻¹⁹ | −1 |
| Proton | 1,007277 | 1,673 × 10⁻²⁴ | +1,602 × 10⁻¹⁹ | +1 |
| Nötron | 1,008665 | 1,675 × 10⁻²⁴ | 0 | 0 |
Bir element atomunun çekirdeğinde bulunan proton sayısı, o elementin atom numarasını verir. Bu sayı, “Z” harfi ile gösterilir. Atom numarası aynı zamanda çekirdeğin pozitif yükünü de belirler.
Atom numarası = Çekirdek yükü = Proton sayısı
Bir element atomunun çekirdeğinde bulunan yüksüz taneciklerin sayısı, o elementin nötron sayısını verir. Hidrojenin izotopu olan ¹1H atomu hariç tüm atomlarda nötron bulunur.
Kütle numarası, bir elementin atomunda bulunan proton ve nötron sayılarının toplamıdır. “A” harfi ile gösterilir.
Kütle numarası = Nükleon sayısı
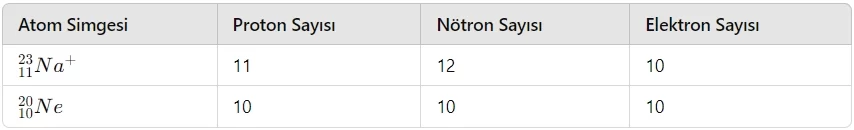
İyon, bir atomda elektron sayısının proton sayısından farklı olduğu durumu ifade eder. Eğer bir atomda elektron sayısı proton sayısından fazlaysa negatif yüklü tanecik (anyon), proton sayısı elektron sayısından fazlaysa pozitif yüklü tanecik (katyon) meydana gelir.
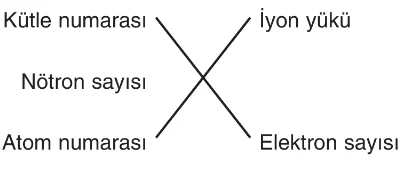
Kütle numarası = Atom numarası + Nötron sayısı
İyon yükü + Elektron sayısı = Atom numarası
Atomla İlgili Tanımlar
- İzotop Atom: Proton sayıları aynı, nötron sayıları farklı olan atomlardır. İzotop atomların kimyasal özellikleri aynı iken, fiziksel özellikleri farklıdır.
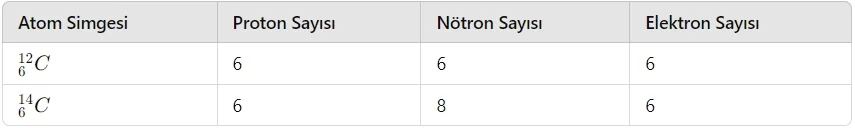
- Not: Proton sayıları aynı, nötron ve elektron sayıları farklı olan tanecikler, izotop tanecikler olarak adlandırılır. İzotop taneciklerin hem kimyasal hem de fiziksel özellikleri farklıdır.
- İzoton Atom: Nötron sayıları aynı, proton sayıları farklı olan atomlardır. İzoton atomların hem kimyasal hem de fiziksel özellikleri farklıdır.
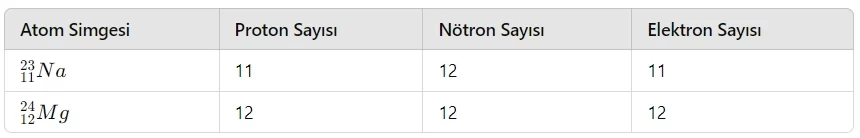
- İzobar Atom: Kütle numaraları aynı, proton sayıları farklı olan atomlardır. İzobar atomların hem kimyasal hem de fiziksel özellikleri farklıdır.
- İzoelektronik Tanecik: Proton sayıları farklı, elektron sayıları ve elektron dizilimleri aynı olan taneciklerdir. İzoelektronik taneciklerin kimyasal ve fiziksel özellikleri farklıdır.
Çözümlü Örnek Sorular:
Soru 1:
Dalton’un atom teorisine göre atomlar hangi özelliklere sahiptir?
A) Atomlar bölünebilir ve yok edilebilir.
B) Aynı elementin atomları birbirinin aynıdır.
C) Farklı elementlerin atomları birbirine benzer.
D) Atomlar sadece belirli durumlarda hareket eder.
Çözüm:
Dalton’un atom teorisine göre, aynı elementin atomları birbirine benzer ve aynı özelliklere sahiptir. Ayrıca atomlar bölünemez ve yok edilemez. Farklı elementlerin atomları ise farklıdır.
Sonuç: B) Aynı elementin atomları birbirinin aynıdır.
Soru 2:
Thomson atom modeli hangi kavramı ortaya atmıştır?
A) Elektronların çekirdek etrafında yörüngelerde bulunduğunu
B) Atomların bölünemez olduğunu
C) Atomların pozitif bir küre içinde negatif yüklü elektronlar bulundurduğunu
D) Elektronların belirli enerji seviyelerinde bulunduğunu
Çözüm:
Thomson, atomun pozitif yüklü bir küre olduğunu ve bu kürenin içinde negatif yüklü elektronların gömülü olduğunu öne sürmüştür. Bu modele “üzümlü kek modeli” de denir.
Sonuç: C) Atomların pozitif bir küre içinde negatif yüklü elektronlar bulundurduğunu
Soru 3:
Rutherford’un yaptığı altın levha deneyinde hangi önemli sonuç çıkarılmıştır?
A) Atomun büyük kısmının boşluk olduğu
B) Elektronların rastgele hareket ettiği
C) Atomun sabit bir çekirdeği olmadığı
D) Pozitif yüklü protonların çekirdekte bulunmadığı
Çözüm:
Rutherford’un altın levha deneyi, atomun büyük kısmının boşluktan oluştuğunu ve pozitif yüklü protonların atomun küçük bir merkezinde, yani çekirdekte toplandığını göstermiştir.
Sonuç: A) Atomun büyük kısmının boşluk olduğu
Soru 4:
Bohr atom modeline göre bir elektron daha yüksek enerji seviyesine geçtiğinde ne olur?
A) Elektron enerji kaybeder ve foton yayar.
B) Elektron enerji kazanır ve daha dış yörüngeye çıkar.
C) Elektron çekirdeğe daha yakın bir yörüngeye iner.
D) Elektron tamamen atomdan çıkar.
Çözüm:
Bohr atom modeline göre, bir elektron enerji kazandığında daha yüksek bir enerji seviyesine geçer, yani daha dış yörüngelere çıkar.
Sonuç: B) Elektron enerji kazanır ve daha dış yörüngeye çıkar.
Soru 5:
Modern atom teorisine göre atomun yapısı hakkında aşağıdakilerden hangisi doğrudur?
A) Elektronlar kesin yörüngelerde bulunur.
B) Atom çekirdeği negatif yüklüdür.
C) Elektronlar, belirli olasılıklar çerçevesinde bulunma bölgelerinde yer alır.
D) Atomun tüm kütlesi elektronlardan oluşur.
Çözüm:
Modern atom teorisine göre elektronlar, belirli olasılıklarla bulunma ihtimalleri olan bölgelerde yer alırlar. Bu bölgelere “elektron bulutları” denir ve kesin bir yörünge yoktur.
Sonuç: C) Elektronlar, belirli olasılıklar çerçevesinde bulunma bölgelerinde yer alır.
İyi yazılmış
Anlamlı neyse