Atom Orbitalleri ve Elektron Dizilimi 9. Sınıf Kimya
ATOM ORBİTALLERİ VE ELEKTRON DİZİLİMİ
Atom Orbitalleri
- Schrödinger dalga denklemine göre elektronun dalga özelliğinden dolayı elektronun kesin bir konumundan bahsedilemez. Dalga denklemi ile elektronun bir yerde bulunma olasılığı hesaplanır.
- Elektronların bulunma ihtimalinin yüksek olduğu bölgelere orbital denir. Bir orbital en fazla iki elektron alabilir. s, p, d ve f olmak üzere 4 farklı orbital türü kullanılmaktadır. Orbitaller boş, yarı dolu ya da tam dolu olabilir. Orbital şekillerine sınır yüzey diyagramı da denir.
- s orbitali: Küresel şekildedir. Elektronların bulunma olasılığı açısal koordinatlara bağlı değildir. En fazla 2 elektron alabilir. s orbitali 1. enerji düzeyinden başlar ve her enerji düzeyinde 1 tane bulunur. Çekirdekten uzaklaştıkça s orbitallerinin enerjisi ve büyüklüğü artar.

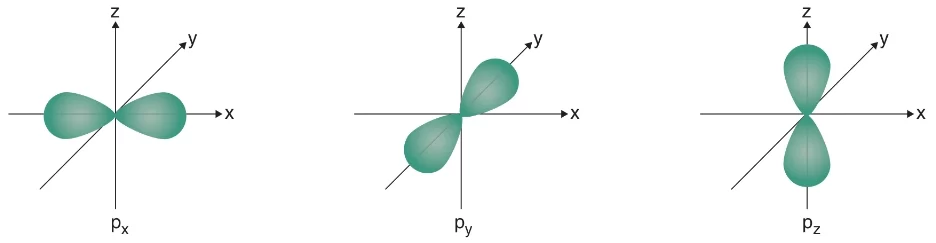
- p orbitali: 2. enerji düzeyinden başlar. Açısal koordinatlara göre farklı olan px, py ve pz olmak üzere üç farklı orbitali bulunur. Bir enerji düzeyinde bulunan p orbitali en fazla 6 elektron alabilir. Aynı enerji düzeyinde bulunan px, py ve pz orbitallerinin büyüklükleri ve enerjileri aynıdır. Çekirdekten uzaklaştıkça p orbitallerinin enerjileri ve büyüklükleri de artar.
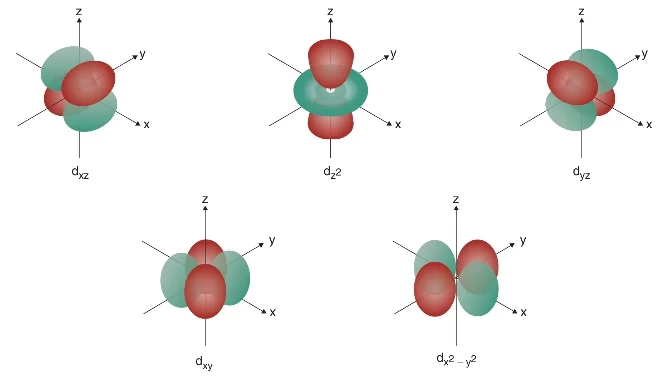
- d orbitali: 3. enerji düzeyinden başlar. Uzayda yönelimleri farklı olan dxz, dz2, dyz, dxy ve dx2−y2 olmak üzere beş farklı orbitalden oluşur. Bir enerji düzeyindeki d orbitali en fazla 10 elektron alabilir. Aynı enerji düzeyinde bulunan d orbitallerinin enerjileri aynıdır.
- f orbitali: 4. enerji düzeyinden başlar. Uzayda yönelimleri farklı olan 7 tane orbitalden oluşur. Bir enerji düzeyindeki f orbitali en fazla 14 elektron alabilir. Şekilleri d orbitallerine göre daha karmaşıktır.
Orbital Türlerinin Bağlı Enerji Düzeyleri
- Tek elektronlu taneciklerde orbitallerin enerjileri arasındaki ilişki aşağıda verilmiştir:

- Çok elektronlu taneciklerde orbitallerin enerji diyagramı, şema gösterimi ve elektronik konfigürasyonu aşağıda verilmiştir.

Yukarıdaki enerji diyagramına göre:
- Enerji kabuğunun sayısı arttıkça orbitallerin de enerjileri artar.
- Enerji kabuğunun sayısı arttıkça kabuklar arası enerji farkı azalır.
- 3. enerji kabuğundan itibaren kabuklar iç içe geçer.
- Aynı enerji kabuğunda bulunan orbitallerin enerji sıralaması, f>d>p>s şeklindedir.
- Aynı tür orbitallerin bulundukları enerji kabuğunun sayısı arttıkça orbitallerin enerjileri artar. (: enerji kabuğu)
Orbitalin bulunduğu enerji kabuğunun sayısı ne kadar büyük ve orbitalin türü ne kadar kompleks ise, orbitalin enerjisi de o kadar fazladır.
enerji kabuğunda en fazla bulunabilecek orbital sayısı , en fazla bulunabilecek elektron sayısı ise ’den hesaplanabilir. (n, pozitif bir tam sayıdır.)
Yörünge ve Orbital Kavramları Arasındaki Farklar
- Yörüngelerde belirli sayılarda elektron bulunabilirken, bir orbitalde en fazla 2 elektron bulunur.
- Yörüngelerin şekli dairesel iken orbitaller farklı şekillere sahiptir.
- Yörüngeler, elektronların bulunduğu dairesel bir yol iken, orbitaller, elektronların bulunma ihtimalinin en fazla olduğu uzay bölgeleridir.
- Yörüngeler, elektronların düzlemsel hareketini, orbitaller ise üç boyutlu hareketini temsil eder.
- Yörüngeler, belirli bir düzey olarak ifade edilirken her enerji düzeyi farklı sayıda ve enerjide orbitaller içerir.

Atomlarda Elektron Dizilimi
Çok elektronlu atomlarda, birden fazla elektronun bulunması, atom orbitallerinin enerji seviyelerini önemli ölçüde etkiler. Atom numarası arttıkça, 2s ve 2p orbitalleri arasındaki enerji farkının artmasının temel nedeni elektronlar arasındaki itme kuvvetleridir. Bu itme kuvvetleri, bir enerji kabuğundaki farklı alt kabukların birbirinden farklı enerji seviyelerine sahip olmasına yol açar.
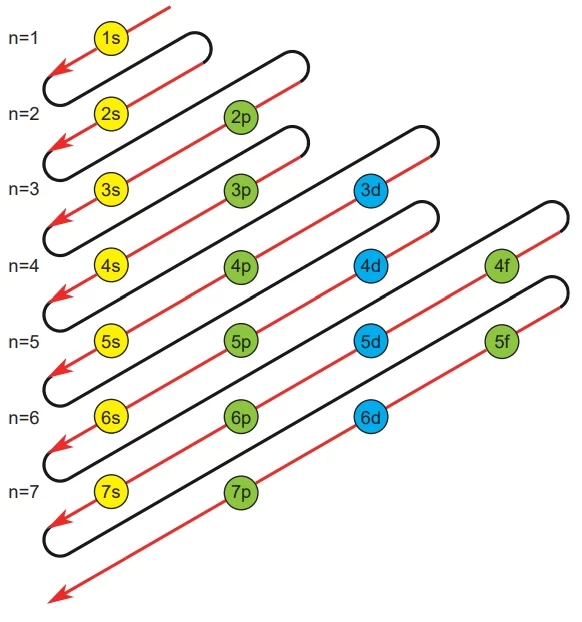
Çok elektronlu atomlarda orbitallerin enerji seviyeleri genellikle şu sıralamaya göre düzenlenir:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f….
Bir alt kabukta yer alan orbitallerin enerjileri birbirine eşittir (örneğin, 3p orbitalleri). Ancak orbitallerin enerji seviyeleri atomdan atoma farklılık gösterir. Bu enerji sıralamasını hatırlamak için elektron dizilimi şeması kullanılabilir.
Belirlenen orbital enerji sıralamasına göre, bir atomun elektronlarının orbitallerdeki dizilimini göstermenin iki farklı yolu vardır. İlk yöntem, elektron konfigürasyonu olarak adlandırılır. Bu yöntemde, önce elektronun bulunduğu temel enerji seviyesi ve orbital tipi yazılır, ardından orbitalde yer alan elektron sayısı üst olarak gösterilir. Bu gösterim yöntemi, aşağıda gösterildiği gibi, elektronların atomdaki düzenini açıklar.
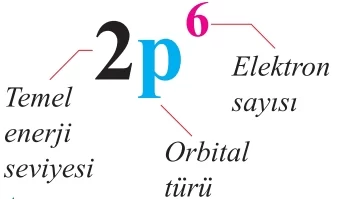
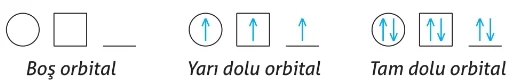
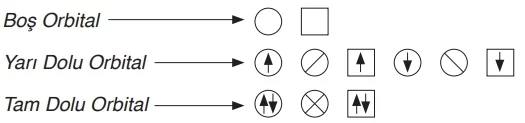
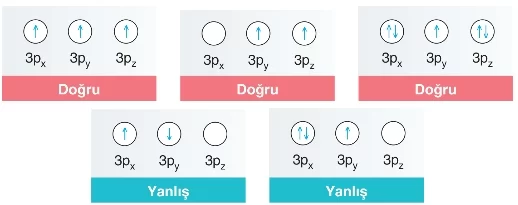
Atomların elektron dizilimi, orbital şeması kullanılarak da gösterilebilir. Bu şemada, geometrik şekiller orbitalleri, şekillerin içindeki semboller ise elektronları temsil eder. Boş, yarı dolu ve tam dolu orbitallerin farklı orbital şemaları ile gösterimi şu şekilde yapılabilir:
Periyodik tablodaki atomların orbitallerinde yer alan gerçek enerji seviyeleri ve elektronların bu orbitallere yerleşme sıralaması, genellikle spektral analizler ve manyetik yöntemler gibi deneysel çalışmalarla belirlenir. Ancak, pek çok atom için elektron dizilimi, Aufbau ilkesi, Pauli dışlama ilkesi ve Hund kuralı gibi kurallar kullanılarak tahmin edilebilir.
Aufbau Kuralı
- Bir atomda elektronlar, en düşük enerjili orbitalden başlayarak yerleşir.
- Çok elektronlu atomlarda orbitallerin enerji sıralaması şu şekildedir:
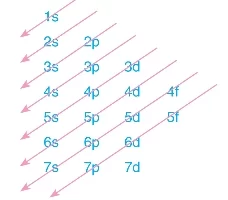
- Aufbau kuralına göre, elektronlar önce enerjisi düşük olan 1s orbitalinden başlayarak doldurulur.
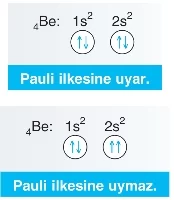
Pauli Dışlama İlkesi
- Bir atomda aynı özelliklere sahip iki elektron bulunamaz. Elektronlar aynı kabukta ve aynı orbitale yerleşseler bile, spinleri farklı olmalıdır.
Hund Kuralı
- Bir atomda, aynı enerji seviyesindeki orbitaller önce aynı yönde birer birer elektronlarla doldurulur. Daha sonra, kalan elektronlar zıt spinlerle doldurulmaya başlanır. Hund kuralına uyan ve uymayan elektron yerleşimi aşağıdaki örneklerle açıklanabilir.
Nötr Atomların Elektron Dizilimi:
| Orbital Türü | Orbital Sayısı | Alabileceği En Fazla Elektron Sayısı |
|---|---|---|
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Bir atomdaki elektronların orbitallere yerleştirilmesi sırasına elektron dizilimi denir. Orbitallerdeki elektronlar orbital şeması ile de gösterilebilir.
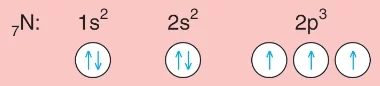


Küresel Simetri Özelliği: Bir taneciğin elektron diziliminde son orbital türünün tam ya da yarı dolu olması durumudur. Elektron dizilimi; s1,p3,?5 vef7 ile bitenler yarı küresel simetri özelliği gösterirken; s2,p6,d10 ve f14 ile bitenler tam küresel simetri özelliği gösterir. Küresel simetri atomlara kararlılık sağlar.
7N: 1s² 2s² 2p³
Yarı küresel simetri özelliği gösterir.
18Ar: 1s² 2s² 2p⁶ 3s² 3p⁶
Tam küresel simetri özelliği gösterir.
Özel Durum: ns²(n − 1)d⁴ ve ns²(n − 1)d⁹ elektron dizilimine sahip atomlarda s orbitalindeki bir elektron d orbitaline aktarılır. Bu sayede atom küresel simetri özelliği gösterir ve daha kararlı hale geçer.
24Cr ve 29Cu’nun elektron dizilimi uyarılmış hâl ile karıştırılmamalıdır.
24Cr: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵
29Cu: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰
Uyarılmış Atom: Bir atomun en kararlı olduğu elektron dizilimine temel hâl denir. Temel hâlde bulunan bir atomdaki bir elektron enerji aldığında daha üst enerji düzeylerinden birine çıkar. Bu atoma, uyarılmış atom denir ve kararsızdır. Kararlı hâle dönmek için aldığı enerjiyi yayar. Uyarılmış atomun elektron dizilimi Aufbau kuralına uymaz. Uyarılmış atomların periyodik sistemdeki yerleri temel hâldeki yerleri ile aynıdır.
Temel hâl: ₆C: 1s² 2s² 2p²
Uyarılmış hâl: ₆C*: 1s² 2s² 2p¹ 3s¹
Çözümlü Örnek Sorular:
Soru 1:
Bir atomun 1s² 2s² 2p⁶ 3s² 3p⁵ şeklinde elektron dizilimi verilmiştir. Bu atomun periyodik tablodaki yeri nedir?
A) 3. periyot, 6A grubu
B) 3. periyot, 7A grubu
C) 2. periyot, 8A grubu
D) 3. periyot, 5A grubu
Çözüm:
Elektron dizilimi incelendiğinde, en dış enerji seviyesindeki elektronlar 3s² 3p⁵’tir. Yani, 3. periyotta ve 7A grubundadır (toplamda 7 valans elektronu var).
Sonuç: B) 3. periyot, 7A grubu
Soru 2:
Bir atomun elektron dizilimi 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ şeklindedir. Bu atomun hangi element olduğunu bulunuz.
A) Sodyum (Na)
B) Potasyum (K)
C) Kalsiyum (Ca)
D) Magnezyum (Mg)
Çözüm:
Verilen dizilimde toplamda 19 elektron bulunmaktadır. Atom numarası 19 olan element potasyum (K)‘dir.
Sonuç: B) Potasyum (K)
Soru 3:
Elektron dizilimi 1s² 2s² 2p⁴ olan bir elementin grup numarası nedir?
A) 4A
B) 5A
C) 6A
D) 7A
Çözüm:
2s² 2p⁴, elementin en dış katmanında 6 elektron bulunduğunu gösterir. Bu element 6A grubunda yer alır.
Sonuç: C) 6A
Soru 4:
Bir elementin elektron dizilimi 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁵ şeklindedir. Bu elementin periyot ve grup numarası nedir?
A) 4. periyot, 7A grubu
B) 4. periyot, 6A grubu
C) 3. periyot, 5A grubu
D) 3. periyot, 6A grubu
Çözüm:
Verilen dizilimde en dış yörüngedeki elektron sayısı 7’dir (4p⁵). Bu, elementin 4. periyotta ve 7A grubunda olduğunu gösterir.
Sonuç: A) 4. periyot, 7A grubu
Soru 5:
Kalsiyum (Ca) atomunun elektron dizilimi nasıldır?
A) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
B) 1s² 2s² 2p⁶ 3s² 3p⁶ 3d²
C) 1s² 2s² 2p⁶ 3s² 3p⁴
D) 1s² 2s² 2p⁶ 3s² 3p⁶ 4p²
Çözüm:
Kalsiyumun atom numarası 20’dir. Elektron dizilimi, 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² şeklindedir.
Sonuç: A) 1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
Çok yardımcı oldu teşekkürler ☺️