Atom Orbitalleri 9.Sınıf Kimya
Bohr atom teorisi, tek elektron içeren atom (H) ve iyonlardaki (3Li²⁺, 4Be³⁺ vb.) elektron davranışlarını açıklayabilir ancak iki veya daha fazla elektrona sahip atomlarda elektron davranışlarını tam olarak açıklayamaz. Bu tür atomların tanımlanması için atom orbitallerinin doğasını, bağlı enerjilerini ve elektronların mevcut orbitalleri nasıl doldurduğunu dikkate almak gerekir.
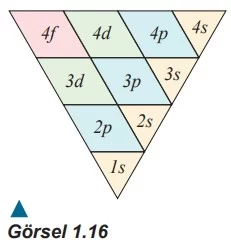
Elektronun yoğun olarak bulunduğu bölge atom orbitalidir. Atom orbitalleri belirli temel enerji seviyelerinde bulunur. Bu temel enerji seviyeleri alt enerji seviyelerine ayrılır. Alt enerji seviyelerinde elektronların bulunma olasılığı orbital adı verilen boşluklarla ilişkilidir. Atom orbitalleri genellikle s, p, d ve f olmak üzere dört çeşittir. İlk temel enerji seviyesinin bir altı, ikinci temel enerji seviyesinin iki altı, üçüncü temel enerji seviyesinin ise üç alt seviyesi vardır ve sıralama bu şekilde devam eder. Bir atom orbitali gösterilirken önce orbitalin bulunduğu enerji seviyesi (n), sonra orbitalin türü yazılır. Örneğin hidrojen atomunda birinci enerji seviyesinde bulunan ve türü s olan orbital, kısaca 1s şeklinde ifade edilir.
s Orbitalleri s orbitalleri küre şeklindedir, tüm enerji seviyelerinde bulunur ve simetriktir. s orbitallerinde elektron bulunma olasılığı açısal koordinatlara bağlı değildir.
p Orbitalleri İkinci enerji seviyesinden başlayan p orbitallerinde elektronların bulunma olasılığı açısal koordinatlara bağlıdır. Açısal koordinatlara göre x, y ve z eksenlerine dik üç tane p orbitali vardır. Bu orbitaller bulundukları eksenin adıyla (px, py, pz) ifade edilir. Aynı enerji seviyesinde bulunan p orbitalleri eş enerjilidir.
d Orbitalleri
Üçüncü enerji seviyesinden başlayan d orbitallerinde elektronun bulunma olasılığı açısal koordinatlara bağlıdır. d orbitalleri farklı yönelimlere sahip beş orbitalden oluşur ve bunlar dxy, dyz, dxz, dx²-y² ve dz² şeklinde adlandırılır. Aynı enerji seviyesindeki d orbitallerinin enerjileri birbirine eşittir.
f Orbitalleri
Dördüncü enerji seviyesinden başlayan f orbitallerinde elektronların bulunma olasılığı açısal koordinatlara bağlıdır. f orbitalleri farklı yönelimlere sahip yedi orbitalden oluşur. Aynı enerji seviyesindeki f orbitallerinin enerjileri birbirine eşittir.

Atomdaki enerji seviyeleri bir amfi tiyatrodaki koltuk sıralarına benzetilebilir. Sahneden uzaklaştıkça daha yüksek ve uzak sıralarda daha fazla koltuk bulunur. Bu durum, bir atomdaki enerji seviyeleri ve bu enerji seviyelerindeki orbital sayısının artışı ile ilişkilendirilebilir. Enerji seviyelerinin çekirdekten olan uzaklığı arttıkça enerji seviyelerinde bulunan orbital sayısı artar.
Çözümlü Örnek Sorular:
Soru 1:
Bir atomun s-orbitalinde en fazla kaç elektron bulunabilir?
A) 1
B) 2
C) 3
D) 6
Çözüm:
s-orbitalinde en fazla 2 elektron bulunabilir. Elektronlar zıt spinli olarak aynı s-orbitalinde yer alırlar.
Sonuç: B) 2
Soru 2:
p-orbitalinde en fazla kaç elektron bulunabilir?
A) 2
B) 4
C) 6
D) 8
Çözüm:
p-orbitalinde 3 tane alt orbital bulunur ve her bir orbitalde 2 elektron yer alabilir. Bu nedenle p-orbitalinde en fazla 6 elektron bulunabilir.
Sonuç: C) 6
Soru 3:
Bir atomun d-orbitalinde en fazla kaç elektron bulunabilir?
A) 2
B) 6
C) 8
D) 10
Çözüm:
d-orbitalinde 5 tane alt orbital bulunur ve her bir orbital 2 elektron tutabilir. Bu nedenle d-orbitalinde en fazla 10 elektron bulunabilir.
Sonuç: D) 10
Soru 4:
Bir atomun p-orbitali hangi enerji seviyesinden itibaren dolmaya başlar?
A) 1. enerji seviyesi
B) 2. enerji seviyesi
C) 3. enerji seviyesi
D) 4. enerji seviyesi
Çözüm:
p-orbitalleri, 2. enerji seviyesinden itibaren dolmaya başlar. 1. enerji seviyesinde sadece s-orbitali bulunur.
Sonuç: B) 2. enerji seviyesi
Soru 5:
f-orbitalinde en fazla kaç elektron bulunabilir?
A) 14
B) 10
C) 8
D) 6
Çözüm:
f-orbitalinde 7 tane alt orbital bulunur ve her bir orbital 2 elektron tutar. Bu nedenle f-orbitalinde en fazla 14 elektron bulunabilir.
Sonuç: A) 14