Atom Modelleri Fizik Ayt
Atom Modelleri
Dalton Modeli
Dalton’a göre tüm elementler atomlardan oluşmuştur. Atomlar birleşerek molekülleri, moleküller de bileşikleri oluştururlar.
Atom, oluşturduğu elementin tüm özelliklerini taşıyan ve bölünemeyen en küçük parçasıdır.
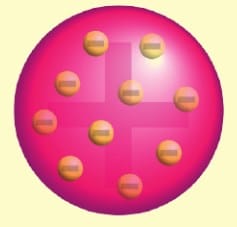
Thomson Atom Modeli
Thomson elektronu keşfetmesinden sonra atomun nötr olabilmesi için yapısında pozitif yükünde olması gerektiğini düşündü. Yaptığı deney sonuçlarına göre, 1907 yılında kendi atom modelini önerdi.
Buna göre;
1 . Atomlar küre şeklindedir.
2. Atomda negatif yüklü elektronlar vardır.
3. Pozitif yükler atomu nötürleyecek şekilde dağılmışlardır.
4. Elektronun kütlesi atomun kütlesinden çok küçüktür.
Thomson atom modeli üzümlü kek modeli olarak da bilinir. Yani (+) ve (—) yükler atomun içinde, kekin içindeki üzümler gibi her bir tarafa dağılmış haldedir.
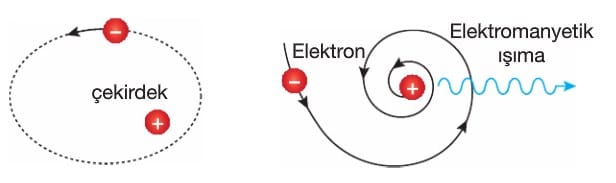
Rutherford Atom Modeli
Rutherford yaptığı deneyde α (alfa) parçacıklarını çok ince altın levha üzerine gönderdi ve sonuçları incelendi.
Alfa taneciklerinin çoğu yön değiştirmeksizin altın levhanın arkasına geçiyor ve bazı alfa tanecikleri ise büyük açılarla sapmaya uğruyordu. Rutherford’a göre, atom merkezinde çok yoğun ve (+) yüklü bölgeye çekirdek dedi ve atomun çapına göre çok daha küçük olduğunu söyledi.
Rutherford atom modeline göre;
1. Atom çekirdekli yapıdadır.
2. Atomun içinde boşluk vardır.
3. Elektronlar çekirdek çevresinde hareket etmektedir.
Rutherford Modelinin Yetersizlikleri
İvmeli hareket eden yüklerin ışıma yaptığı bilinmektedir. Elektronlar çekirdek etrafında dairesel hareket yaparlar. Dairesel hareket ivmeli bir harekettir ve ivmeli hareket yapan elektronun sürekli ışıma yapması gerekir.
Işıma yapan elektronun ise enerji kaybetmesi ve yörünge çapının küçülerek çekirdek üzerine düşmesi gerekir. Bu da atomun her frekansta ışıma yapması demektir. Böyle bir atomun ışıma spektrumunun sürekli olması beklenir. Halbuki atomların ışıma spektrumlarının kesikli olduğu bilinmekteydi.
Yani atomlardan elde edilen spektrumun sürekli olması beklenirken çizgili (kesikli) spektrum elde edilmesinin nedenini bu model açıklayamadı.
Bohr Atom Modeli
İki poslütat ortaya koymuştur. Postülat, farz edilerek düşünülen ön kabuldur.
Bohr, teorisi ile ilgili aşağıdaki temel varsayımlara ulaşmıştır.
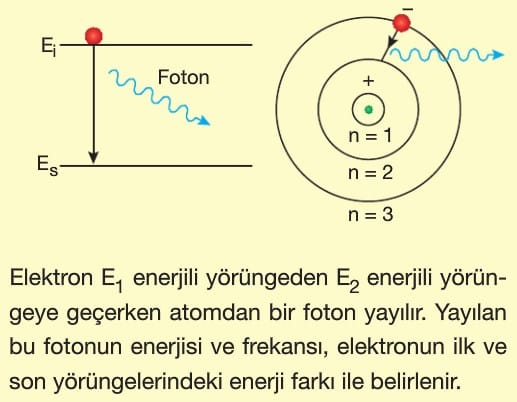
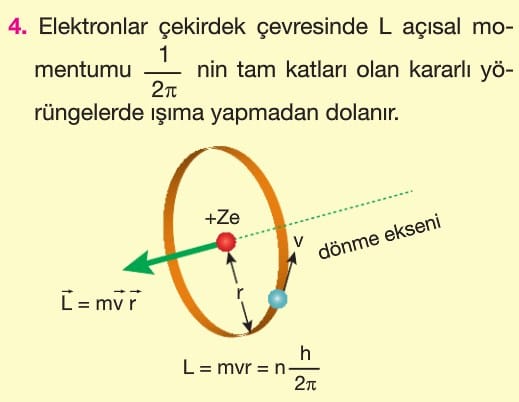
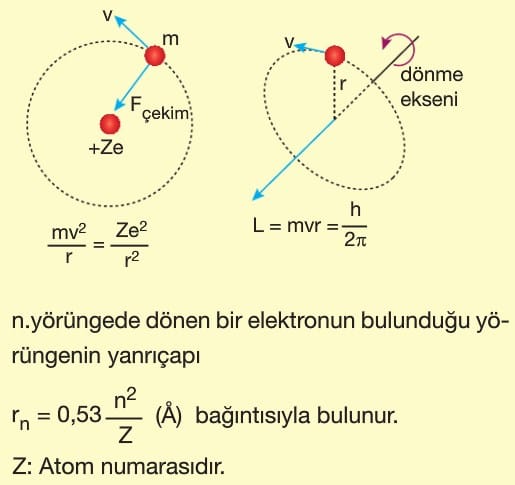
1. Elektronlar artı yüklü çekirdek çevresinde Coulomb kuvvetinin çekme etkisi ile dairesel bir yörüngede ışıma yapmadan dolanırlar.
2. Bazı elektron yörüngeleri kararlıdır ve elektron bu kararlı yörüngelerde ışıma yapmaz.
3. Bir elektron yüksek enerjili kararlı bir yörüngeden düşük enerjili kararlı bir yörüngeye kendiliğinden geçebilir.
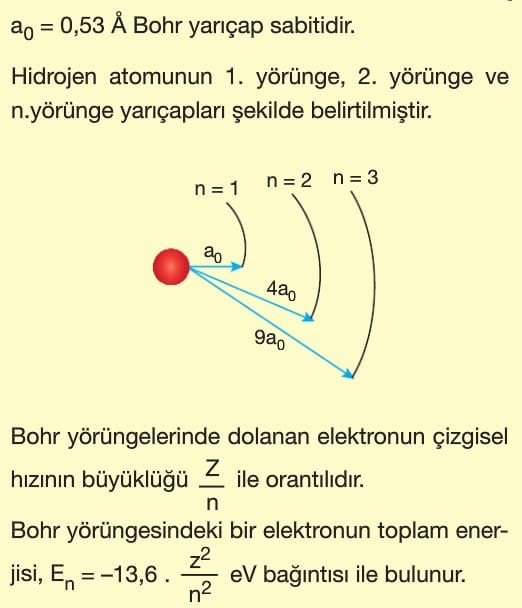
Bir elektronun uzaktaki bir yörüngede iken sahip olduğu enerji, çekirdeğe daha yakın bir yörüngede iken sahip olduğu enerjiden daha büyüktür.
Bağıntının önündeki (—) işareti bu anlamı verdiği gibi elektronun çekirdeğe bağlı olduğunu da göstermektedir.
Bohr atom modelinin yetersiz olduğu durumlar;
1. Elektron sayısı birden fazla olan atomlardaki olayları açıklayamamaktadır.
2. Işığın spektrum çizgilerindeki küçük ayrılmaların sebebini açıklayamamıştır.
3. Atomların spektrumundaki bazı çizgilerin daha parlak olmasının sebebini açıklayamaz.
4. Atomların bileşik yapmasını açıklayamaz.








Çok güzel notlar. Ellerinize,emeğinize sağlık.