Asitler ve Bazlar 10. sınıf kimya
Asit-Baz Tanımları
- Canlılar için yaşamsal bir öneme sahip olan asitler ve bazların yapılarını ve özelliklerini bilmek bizler için büyük bir önem arz eder.
- Asit ve bazlara ilişkin ilk bilimsel tanım İsviçreli bilim insanı Svante Arrhenius tarafından yapılmıştır.
- Arrhenius’a göre, suda çözündüğünde suya H+ iyonu veren maddeler asit, OH– iyonu veren maddeler bazdır.
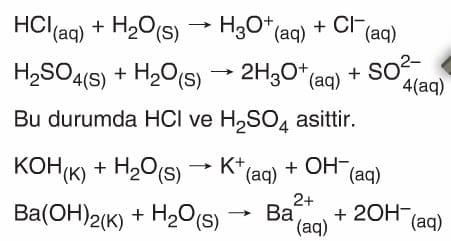
- Bu tanıma göre HCl, H2SO4, HNO3 gibi maddeler asit, NaOH, Mg(OH)2 gibi maddeler bazdır.
- Asitlerin sulu çözeltilerinde oluşan hidrojen iyonu (H+) çözücü (Su) ortamında serbest hâlde bulunmaz. H2O molekülüyle hidrojen bağı yaparak HaO+ (hidronyum) iyonuna dönüşür.
- Arrhenius, yapısında H+ iyonu bulunmayan asitler ile OH– iyonu bulunmayan bazları açıklayamamıştır.
Uyarı:
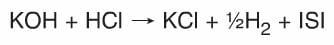
- Her asit baz tepkimesinden mutlaka tuz oluşur. Suyun oluşumu asit ve bazın yapısına bağlıdır.
- Bütün nötralleşme tepkimeleri ekzotermiktir.
Asitlerin Özellikleri
- Tatları ekşidir.
- Sulu çözeltilerinde H3O+ (hidronyum) iyonu fazlalığı vardır.
- Genellikle suda iyi çözünürler.
- Sulu çözeltileri elektrik akımını iletir.
- Mavi turnusol kağıdını kırmızıya boyarlar.
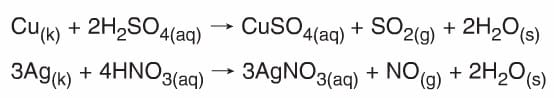
- Aktifliği hidrojenden fazla olan metallerle tepkime vererek metalin tuzunu ve H2 gazını oluştururlar.
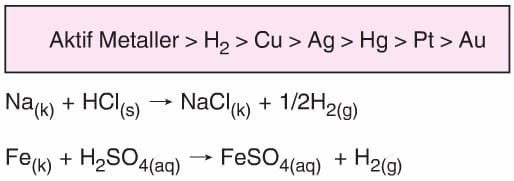
- Oksijeni olmayan anorganik asitler (HCl, HBr, Hl gibi) aktifliği Hidrojenden az olan metaller ile tepkimeye girmez.
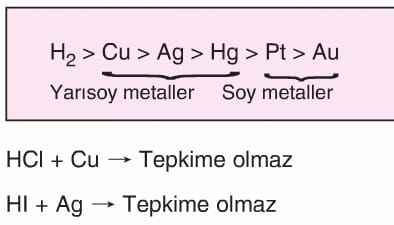
- Yapısında oksijen bulunan anorganik asitler yarısoy metaller ile tepkime verir. Ancak buradan H2 gazı yerine asitin anyonundan gelen SO2, CO2, NO2 gibi gazlar oluşur.
Uyarı: Asitler, solunum ve sindirim yoluyla alındıklarında cilde temas ettiğinde ciddi sağlık sorunları oluşur.
Bazların Özellikleri
- Tatları acıdır.
- Sulu çözeltilerinde OH– iyonu fazlalığı vardır.
- Temas edildiklerinde ele kayganlık hissi verirler.
- Sulu çözeltileri elektrik akımını iletir.
- Kırmızı turnusolu maviye çevirir.
- Alkali metallerin hidroksitleri (NaOH, KOH gibi) hariç diğerlerinin sudaki çözünürlükleri genellikle azdır.
- Kuvvetli bazlar (Alkali metallerin oksit ve hidroksitleri.) amFoter metallerle (Zn, AI, Cr, Pb, Sn gibi…) tepkime vererek tuz ve H2 gazını oluştururlar.
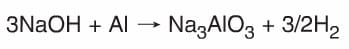
- Bazlar, asitler ile nötralleşme tepkimesi verir.
- Aşındırıcı ve tahriş edicidirler. Sodyum hidroksit (NaOH) nem çekicidir. Ele temas ederse ciddi yanıklara sebeb olur.
Uyarı
- Asit ya da bazlar cilde temas ettiğinde bol su ile yıkanmalıdır.
- Metal oksitlerde oksijenin kütlece yüzdesi arttıkça asidik özelliği artar.
Oksitlerin Asidik ve Bazik Özelliği
Elementlerin oksijen ile yaptıkları bileşiklere oksit denir. Oksitleri aşağıdaki gibi sınıflandırabiliriz. (O2– oksit iyonu)
Asidik Oksitler
Moleküllerinde birden fazla oksijen atomu bulunduran ametal oksitlerdir.
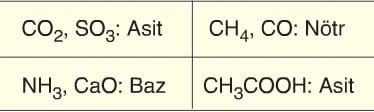
Asidik oksitler genellikle ametal oksitlerdir. Örneğin: SO₂, CO₂, SO₃, N₂O₅ gibi.
- Su ile birleşiklerinde asitleri oluştururlar.
Örnek: SO₃ + H₂O → H₂SO₄ - Bazlarla birleşerek tuzları oluştururlar.
Örnek: CO₂ + 2KOH → K₂CO₃ + H₂O
Bazik Oksitler
Genellikle metal oksitler bazik özellik gösterir.
- Alkali metallerin oksitleri ve hidroksitleri kuvvetli bazlardır.
- Bunlar suda çok çözünür. Diğerleri çok az çözünür.
Örnek: Na₂O + H₂O → 2NaOH
- Bunlar suda çok çözünür. Diğerleri çok az çözünür.
- Bazik oksitler asitlerle tepkime verirler.
Örnek: Na₂O + HCl → NaCl + H₂O
Nötr Oksitler
Ametal oksitlerde oksijen atomu sayısı 1 olan oksitlerdir. Örneğin: N₂O, NO, CO gibi.
- Nötr olduklarından asit ve bazlarla tepkime vermezler.
- Yanarak asit oksitlerine dönüşürler.
Örnek: 2CO + O₂ → 2CO₂
Amfoter Oksitler
Hem asitlerle hem de kuvvetli bazlarla tepkime veren oksitlere amfoter oksitler denir. Bu oksitler, amfoter metallerin oksitleridir. Örnek: ZnO, Al₂O₃ gibi.
- ZnO + HCl → ZnCl₂ + H₂O
- ZnO + NaOH → Na₂ZnO₂ + H₂O
Asitlerin Suda Çözünme Tepkimeleri
Bazların Suda Çözünme Tepkimeleri
➤ Suda çözüldüklerinde hemen hemen tüm molekülleri iyonlarına ayrışan asitlere ve bazlara kuvvetli asit ve bazlar denir.
- Kuvvetli Asitler: H₂SO₄, HNO₃, HClO₄, HCl, HI, HBr
- Kuvvetli Bazlar: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)₂
➤ Suda çözüldüğünde çok az bir kısmı iyonlarına ayrışan asit ve bazlara zayıf asit ya da baz denir.
- Zayıf Asitler: HCOOH, CH₃COOH, HF, H₂S
- Zayıf Bazlar: NH₃, PH₃, CH₃NH₂, Fe(OH)₃, AgOH
İndikatör Nedir?
- İndikatörler doğal ya da yapay yollardan elde edilebilir.
- Ortanca çiçeği, lahana, çay, nar, kuzu kulağı gibi bitkilerden indikatörler yapılabilir.
- Laboratuvarlarda kullanılan indikatörlerden bazıları, asidik ve bazik ortamda oluşturdukları renk değişimleri aşağıda verilmiştir.
- Turnusol indikatörü kuzu kulağı bitkisinin özsuyundan elde edilir.
- İndikatörler, asitlik-bazlık derecesini göstermezler, sadece ortamın asidik mi yoksa bazik mi olduğunu belirler.
Çözümlü Örnek Test Soruları
1. BÖLÜM: Asitler ve Bazlar
- Aşağıdaki maddelerden hangisi asit özellik gösterir?
A) NaOH
B) HCl
C) NH₃
D) KOHÇözüm: HCl, hidroklorik asit olup asit özellik gösterir. Diğer maddeler bazdır. Doğru cevap B‘dir. - Asitler sulu çözeltilerinde hangi iyonu oluşturur?
A) OH⁻
B) H⁺
C) Na⁺
D) Cl⁻Çözüm: Asitler sulu çözeltilerinde H⁺ (hidrojen iyonu) oluştururlar. Doğru cevap B‘dir. - Aşağıdakilerden hangisi bazik bir çözeltiyi ifade eder?
A) pH = 2
B) pH = 7
C) pH = 9
D) pH = 5Çözüm: pH değeri 7’den büyük olan çözeltiler baziktir. Bu nedenle pH = 9 bazik bir çözeltidir. Doğru cevap C‘dir. - Aşağıdakilerden hangisi asitlerin özelliklerinden biri değildir?
A) Suda çözündüğünde H⁺ iyonu verir.
B) Mavi turnusol kağıdını kırmızıya çevirir.
C) Elektrik akımını iletir.
D) Acı tat verir.Çözüm: Asitler ekşi tat verir, acı tat bazlara aittir. Doğru cevap D‘dir. - Aşağıdaki maddelerden hangisi bazdır?
A) NaOH
B) H₂SO₄
C) CH₃COOH
D) HNO₃Çözüm: NaOH, sodyum hidroksit olup kuvvetli bir bazdır. Diğer maddeler asittir. Doğru cevap A‘dır. - Bir çözeltinin pH değeri 13’tür. Bu çözelti hakkında ne söylenebilir?
A) Güçlü bir bazdır.
B) Güçlü bir asittir.
C) Nötrdür.
D) Zayıf bir asittir.Çözüm: pH değeri 7’den büyük olan çözeltiler baziktir. pH 13, güçlü bir bazın göstergesidir. Doğru cevap A‘dır.
ASİTLERİN ÖZELLİKLERİ
Bazı mantar türleri zehirli, bazıları ise değildir. Amanita muscaria (emanita muskariya) (Görsel 3.1.1) doğada bulunan birçok mantar türünden biridir. Amanita muscaria yapısında ibotenik asit bulunan zehirli bir mantardır. İbotenik asit insanların merkezi sinir sistemini etkiler. İnsan vücuduna birçok olumsuz etkisi olduğu gibi tüketenler için az da olsa ölüm riski taşır. Gazetelerde veya televizyon programlarında mantar zehirlenmesi haberlerini okumuş ya da görmüşsünüzdür. Gıda maddeleri yapılarında birçok kimyasal madde bulundurur. Bu kimyasal maddeler asit veya baz olabilir. Bazı meyvelere ekşi tadı yapılarında bulunan asitler verir. Örneğin elmaya ekşi tat veren içerdiği malik asittir. Bazı üzümlerde tartarik asit, zeytin yağında oleik asit, ekşimiş sütte laktik asit bulunur. Sirkenin yapısında asetik asit, limonun yapısında ise sitrik asit bulunur (Görsel 3.1.2). Gıda maddelerinde bulunan asitlerin birçoğu zayıf asit olduğu için insan sağlığına, mide rahatsızlığı olanlar hariç, zarar vermez. Limon suyunun mermeri aşındırdığına, sirkenin kireç lekelerini çıkardığına şahit olmuşsunuzdur. Asitler aşındırıcı özelliğe sahiptir.
Hardal (Görsel 3.1.3) ve acı biber gibi bazı gıda maddelerinin tadı acıdır. Bu gıda maddelerine acı tadı veren yapılarında bulunan bazlardır. Bazlar sadece gıda maddelerinin yapısında değil, günlük hayatta kullandığımız kireç, sabun, deterjan, çamaşır sodası gibi maddelerin yapısında da bulunmaktadır. Bu maddeler ciltle temas ettiğinde ciltte kayganlık hisssi oluşturur. Bunun nedeni bu maddelerin yapısında bulunan bazların ciltteki yağ asitleri ile tepkimeye girerek sabun oluşturmasıdır.






