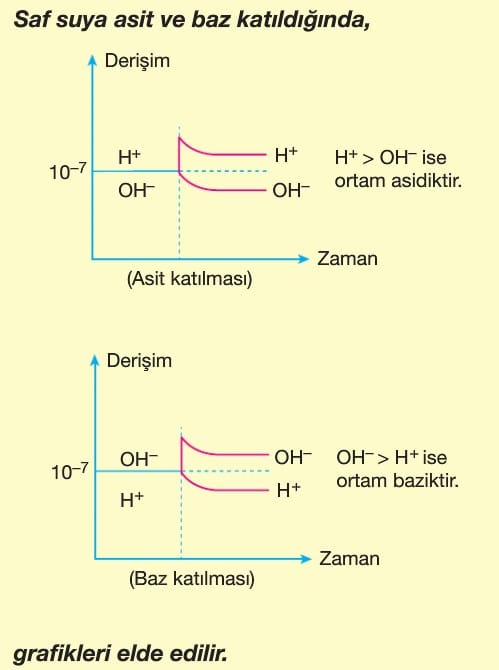
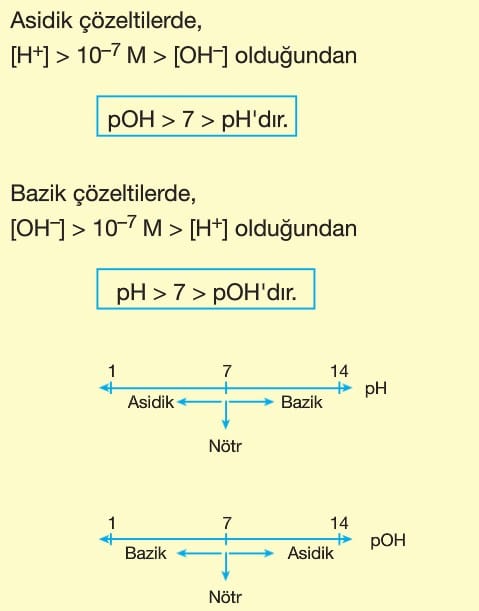
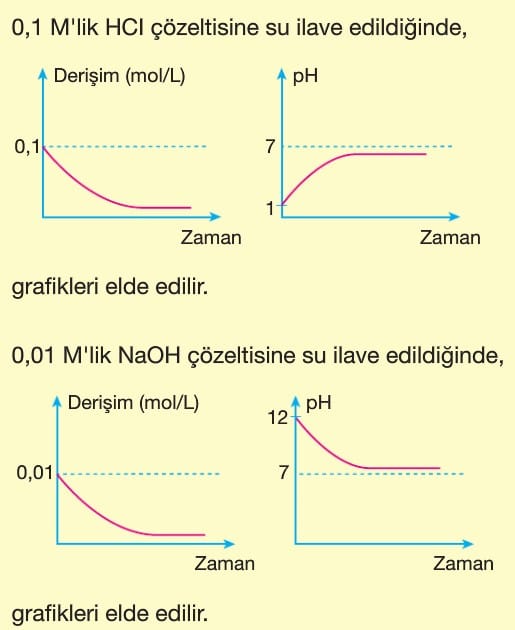
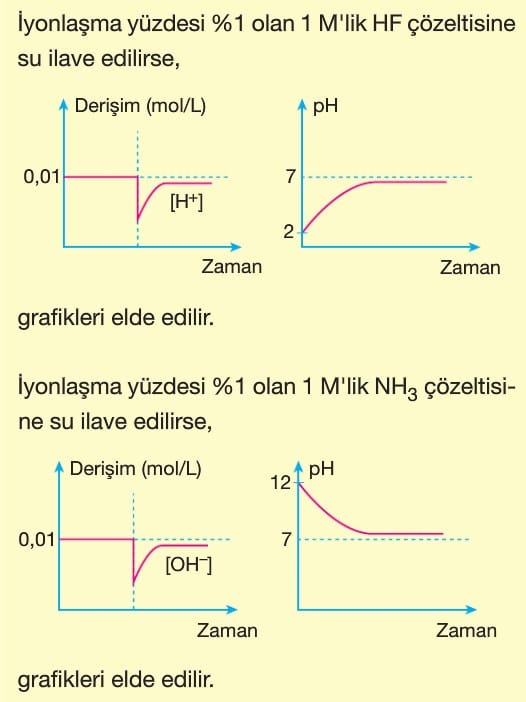
Asitler Ve Bazlar Kimya Ayt
ASİTLER VE BAZLAR
Arrhenius Asit – Baz Tanımı:
Arrhenius’a göre asitler ve bazlar suda çözündüklerinde verdikleri iyon türüne göre tanımlanır. Suda çözüldüklerinde H+ iyonu verebilen maddelere asit, OH– iyonu verebilen maddelere baz denir.
Bronsted – Lowry Asit – Baz Tanımı:
Arrhenius’un asit — baz tanımı sulu çözeltiler için geçerlidir. Yapısında H+ iyonu bulunmayan CO2, SO2 ve SO3‘ün asit özelliği, yapısında OH– iyonu bulunmayan CaO ve NH3‘ün baz özelliği yapılan çalışmalar sonunda tespit edilmiştir. Bu maddelerin asit veya baz olduğunu belirlemede Arrhenius tanımı yetersiz kalmaktadır. Bronsted – Lowry tanımı proton (H+) transferine dayanır.
Proton verebilen maddelere asit, proton alabilen maddelere baz denir.
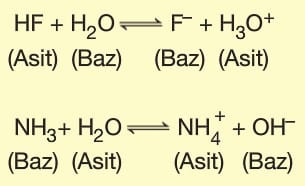
Bronsted — Lowry asit – baz tepkimeleri iki asit baz çiftinin bulunduğu denge tepkimeleridir. Bu tepkimelerdeki asit – baz çiftine Konjuge (Eşlenik) asit Baz Çifti denir.
Lewis Asit – Baz Tanımı:
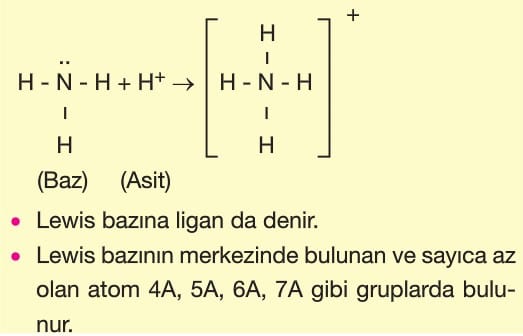
Lewis’e göre bir tepkimede elektron çifti alabilen maddelere asit, elektron çifti verebilen maddelere baz denir.
Asitlerin Genel Özellikleri
Asitler, ametallerin anyon halindeki köklerinin hidrojenli bileşikleridir.
Tatları ekşidir. Süt ve süt ürünlerindeki laktik asit, midede bulunan hidroklorik asit, limondaki sitrik asit ve sirke yapımında kullanılan asetik asit ekşi tada sahiptir.
Ametallerin oksijence zengin bileşikleri asidik özellik gösterir.
SO2, SO3, CO2, N2O3, N2O5
Sulu çözeltileri turnusol kağıdının rengini kırmızıya çevirirler.
Bazların Genel Özellikleri:
Bazlar, metallerin hidroksitli (OH–) bileşikleridir.
Sulu çözeltileri OH– ve farklı iyonlara sahip olduğundan elektrolit (elektriği ileten) özelliktedir.
Sulu çözeltileri ele kayganlık hissi verir. (Sabunlu su kaygandır)
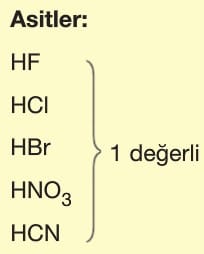
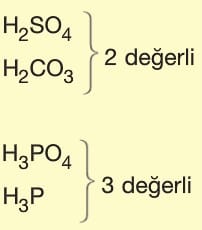
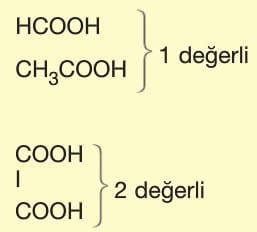
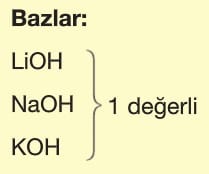
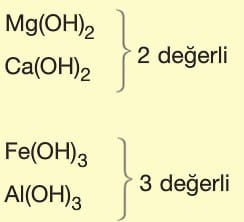
Asit ve Bazların Tesir (Etki) Değerliği:
Tesir değerliği,
Asit ve bazların suya verdikleri H+ ve OH– sayısına göre belirlenir.
Redoks tepkimelerinde alınan ya da verilen elektron sayısına göre belirlenir.
Organik asitlerde karboksil (—COOH) grubu sayısına göre belirlenir.
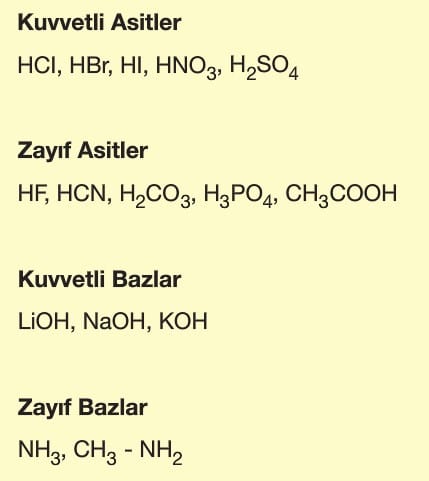
Asit ve Bazların Kuvveti:
Bir asit veya bazın kuvveti suda çözüldüğünde suya verdikleri H+ ve OH– iyonlarının sayısına (iyonlaşma yüzdesi) bağlıdır.
Suda çözünen asit veya bazın iyonlaşma yüzdesi arttıkça kuvveti de artar.
İyonlaşma yüzdesine göre asit ve bazlar kuvvetli ve zayıf olarak ikiye ayrılır.
Kuvvetli asit ve bazlar elektriği iyi iletirken, zayıf asit ve bazlar elektriği az iletir.
Periyodik cetvelde soldan sağa doğru gidildikçe ametallerin oksitlerinin asitlik kuvveti artar.
7A grubu elementlerinin yukarıdan aşağıya doğru hidrojenli bileşiklerinin asitlik kuvveti artar.
Aynı ametalin oksijenli bileşiklerinde oksijen sayısı arttıkça asitlik kuvveti artar.