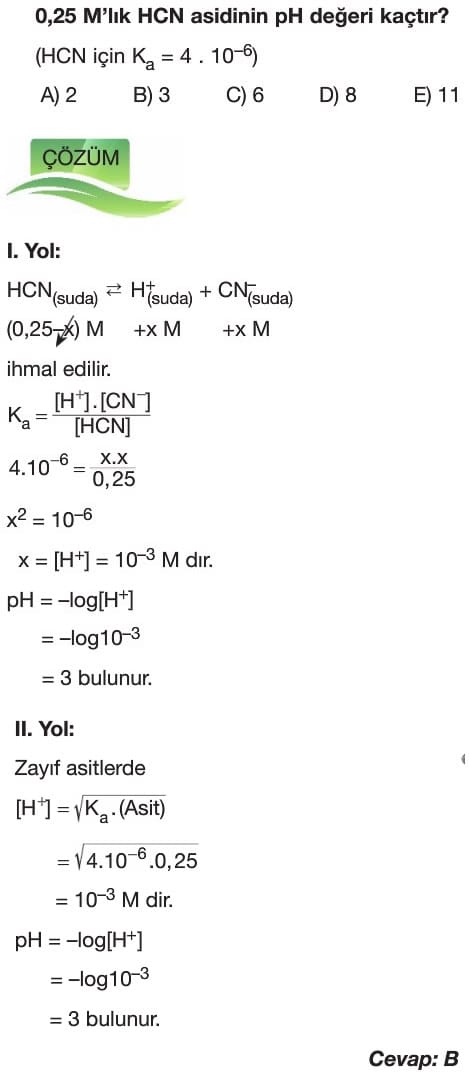
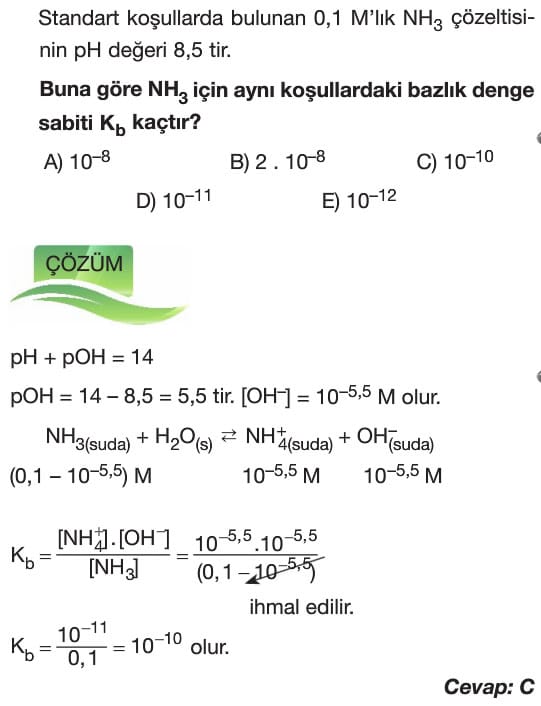
Asit ve Bazların Ayrışma Dengesi 11. Sınıf Kimya
- Zayıf asit ve bazlar suda %100 oranında çözünmez. Bundan dolayı zayıf asit ya da baz çözeltilerinde denge kurulur.
- Zayıf asit ve bazlardaki H+ ya da OH– iyonları derişimleri asit ya da bazın denge bağıntıları ve iyonlaşma sabitleri kullanılarak hesaplanmalıdır.
- Aşağıda bazı zayıf asit ya da bazın iyonlaşma denklemleri ve denge bağıntıları verilmiştir.
–> Zayıf asit olan HCN’nin iyonlaşma denklemi,
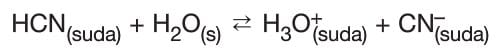
şeklindedir.
–> Asidin iyonlaşma sabiti (Ka) ise,

–> Zayıf baz olan NH3’ün iyonlaşma denklemi,
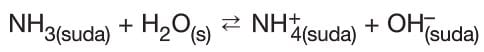
–>Bazın iyonlaşma sabiti (Kb) ise,

- Asit ya da baz çözeltilerinde iyonlaşan moleküllerin yüzdesine iyonlaşma yüzdesi denir. İyonlaşma yüzdesi çözeltiye sabit sıcaklıkta saf su ilave edildikçe artar.
- Ka arttıkça asidin sudaki iyonlaşma yüzdesi ve asidin kuvveti artar.
- Kb arttıkça bazın sudaki iyonlaşma yüzdesi ve bazın kuvveti artar.
- Ka ≥ 10 ise asit çok kuvvetlidir.
- Ka‘sı büyük olan bir asit, Ka‘sı küçük olan asitten daha kuvvetlidir.
- Kb‘si büyük olan bir baz, Kb‘si küçük olan bazdan daha kuvvetlidir.
- Bir asit ne kadar kuvvetli ise eşlenik bazı 0 kadar zayıftır.
- Bir baz ne kadar kuvvetli ise eşlenik asidi 0 kadar zayıftır.
- Ka ile Kb denge sabitleri arasında;
Ka . Kb = Ksu = 10-14 ilişkisi vardır. (25 °C’de) - Bir değerli zayıf asit ya da bazlarda H+ ya da OH– iyonlarının molar derişimleri aşağıdaki formüllerle de hesaplanabilir.
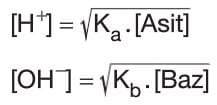
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 0 YORUM